
分析 (1)酸是指在水溶液中电离时产生的阳离子全部是氢离子的化合物;碱是指在水溶液中电离出的阴离子全部是氢氧根离子的化合物;
电解质是在熔融状态或水溶液中能导电的化合物;非电解质在熔融状态下和水溶液中不能导电的化合物;
氧化物是由两种元素构成,其中一种是氧元素的化合物;
(2)电解质是在熔融状态或水溶液中能导电的化合物;非电解质在熔融状态下和水溶液中不能导电的化合物.
解答 解:(1)②HNO3在水溶液中电离时产生的阳离子全部是氢离子,属于酸;⑧NaOH 在水溶液中电离出的阴离子全部是氢氧根离子,属于碱,⑦H2O 是由H元素和O元素构成的化合物属于氧化物;
故答案为:②;⑧;⑦;
(2)①在水溶液里或熔融状态下能导电的化合物是电解质.
②MgCl2晶体在水溶液能电离出自由移动的离子,所以其水溶液能导电,故MgCl2晶体是电解质⑥BaSO4在熔融状态下能电离出自由移动的离子,在熔融状态下能导电,所以是电解质.
故答案为:②⑥.
②在水溶液里和熔融状态下都不能导电的化合物是非电解质.①乙醇、③蔗糖在水溶液里和熔融状态下都不能电离出自由移动的离子,所以是非电解质.
故答案为:①③.
点评 本题考查学生物质的分类以及酸、碱、氧化物、电解质、非电解质的概念等知识,属于基本知识的考查,难度不大.


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:选择题
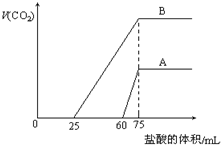 取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )
取等物质的量浓度的NaOH溶液两份A和B,每份10mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.2mol•L-1的盐酸,标准状况下产生的CO2气体体积与所加的盐酸溶液体积之间的关系如图所示,下列叙述正确的是( )| A. | A曲线表明原NaOH溶液中通入CO2后,所得溶液中的溶质成分是 Na2CO3和NaHCO3 | |
| B. | B曲线中消耗盐酸0<v(HCl)<25mL时发生的离子反应为:OH-+H+=H2O H++CO32-=HCO3- | |
| C. | B曲线表明原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为224mL | |
| D. | 原NaOH溶液的物质的量浓度为1.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0×10-7 mol•L-1 | B. | 0.1×10-7 mol•L-1 | ||
| C. | 1.0×10-14/2.0×10-7 mol•L-1 | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 CH3COOH溶液 | D. | 0.5 mol•L-1 KCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:3 | C. | 2:3 | D. | 3:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由反应①知CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H>-574 kJ•mol-1 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 0.2 mol CH4还原NO2至N2,放出的热量为173.4 kJ | |
| D. | 若用标准状况下4.48 L CH4还原NO2至N2,整个过程中转移的电子总数为1.60 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com