
| N2��g��+3H2��g��?2NH3��g�� | |||
| N2 | H2 | NH3 | |
| ��ʼŨ��mol/L | 1.0 | 3.0 | 0.2 |
| 2sĩŨ��mol/L | 0.6 | 1.8 | 1.0 |
| 4sĩŨ��mol/L | 0.4 | 1.2 | 1.4 |
| A��2sĩ�����ķ�Ӧ����Ϊ0.4mol/��L?s�� |
| B��ǰ2sʱ���ڰ�����ƽ����Ӧ����Ϊ0.4mol/��L?s�� |
| C��ǰ4sʱ���ڰ�����ƽ����Ӧ����Ϊ0.3mol/��L?s�� |
| D��2s��4sʱ���ڰ�����ƽ����Ӧ����Ϊ0.2mol/��L?s�� |
| ��c |
| ��t |
| 0.8mol/L |
| 2s |
| 1.2mol/L |
| 4s |
| 0.4mol/L |
| 4s-2s |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ���Ϻ���ʮ��У2011�����12��������ѧ���� ���ͣ�022
| |||||||||||||||||||||||||||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�»���2��22�յ� ����22��15ʱ��ɽ������ú���¹������73�����ѡ����¹�����ָ�Ӳ����ܣ����ѳ����������¹�ԭ��Ϊ���¾ֲ���˹��ը���ÿ����¹�ʱ���¹��п�436�ˣ���375��½��������������������Ч�����ĺ;����ѷ�����������Ŀ���73�ˡ�����113��סԺ�۲죬����21�����ƽ��ء�Ŀǰ��ɽ������ȫ���Ѿȱ����ߣ���һ���Ѿ�����14ʱ������Ŀǰ�ڶ����Ѿ��Ų��Ѿ�չ����ͬʱɽ��ʡ����ȡ��ʩ��ֹ�����ֺ�������ú������ը�¹ʵ�Ԫ����ú��ӵ����к��еļ��顣
![]() �����й��ڼ���������д�����ǣ� ��
�����й��ڼ���������д�����ǣ� ��
![]() A.���������һ�ֳ����������͵ġ������Լ��ķǼ��Է���
A.���������һ�ֳ����������͵ġ������Լ��ķǼ��Է���
![]() B.���������������ԭ�ӱ���ȡ�����γ����ֲ�ͬ�ṹ�ķ���
B.���������������ԭ�ӱ���ȡ�����γ����ֲ�ͬ�ṹ�ķ���
![]() C.��������Ҫ�Ļ���ԭ�ϣ���ֽ��������ںϳɰ�����ҵ
C.��������Ҫ�Ļ���ԭ�ϣ���ֽ��������ںϳɰ�����ҵ
![]() D.���顱���ӵ��еļ��飬�ȿ��������ȼ�ϣ��ֿɷ�ֹ��ը
D.���顱���ӵ��еļ��飬�ȿ��������ȼ�ϣ��ֿɷ�ֹ��ը
![]() ����֪ij���������η���E��ֱ���η���G�ڹ��������·�Ӧ������һ��ֱ���η���M�ͱ��ε�������L(���E.G.L.M���ӵ�Ԫ��ԭ��������С��18)����G�����е�ԭ�Ӵ���E�������ԭ�ӵ���һ���ڡ���Ӧ����ͼʾ���£�
����֪ij���������η���E��ֱ���η���G�ڹ��������·�Ӧ������һ��ֱ���η���M�ͱ��ε�������L(���E.G.L.M���ӵ�Ԫ��ԭ��������С��18)����G�����е�ԭ�Ӵ���E�������ԭ�ӵ���һ���ڡ���Ӧ����ͼʾ���£�
![]()
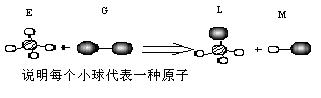
![]() ����E��G����ȡ����Ӧ��ȡ����ƷM��Һ�������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС��ͨ����ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�
����E��G����ȡ����Ӧ��ȡ����ƷM��Һ�������ڹ�ҵ���ѳ�Ϊ��ʵ��ij��ѧ��ȤС��ͨ����ʵ������ģ���������̣�����Ƶ�ģ��װ�����£�
![]()
![]()

����Ҫ����գ�
![]() ��Bװ�������ֹ��ܣ��ٿ��������ٶȣ��ھ��Ȼ�����壻��
��Bװ�������ֹ��ܣ��ٿ��������ٶȣ��ھ��Ȼ�����壻��
![]() ����V(G)/V(E)=x�������������������M����xֵӦ
����V(G)/V(E)=x�������������������M����xֵӦ
![]() ��Dװ�õ�ʯ���о��Ȼ���KI��ĩ���������� ��
��Dװ�õ�ʯ���о��Ȼ���KI��ĩ���������� ��
![]() ��Eװ�õ������� �����ţ�
��Eװ�õ������� �����ţ�
![]() A.�ռ����� B.����G���� C.��ֹ���� D.����M����
A.�ռ����� B.����G���� C.��ֹ���� D.����M����
![]() ����Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС����������д���û�����ɫС�����Ļ�ѧ����ʽ ��
����Cװ���У�����һ��ʱ���ǿ�����䣬����Ӳ�ʲ������ڱ��к�ɫС����������д���û�����ɫС�����Ļ�ѧ����ʽ ��
![]() ��Eװ�ó����������⣬�������л����E�з����M����ѷ���Ϊ ��
��Eװ�ó����������⣬�������л����E�з����M����ѷ���Ϊ ��
![]() ��װ�û���ȱ�ݣ�ԭ����û�н���β����������β����Ҫ�ɷ�Ϊ
��װ�û���ȱ�ݣ�ԭ����û�н���β����������β����Ҫ�ɷ�Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ�꽭��ʡ����12���¿����ۿ���ѧ�Ծ��������棩 ���ͣ������
I����֪����ӦH2(g) + Cl2(g) = 2HCl(g) ��H= ��184 kJ/mol
4HCl(g)+O2(g) 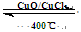 2Cl2(g)+2H2O(g)
��H= ��115.6 kJ/mol
2Cl2(g)+2H2O(g)
��H= ��115.6 kJ/mol
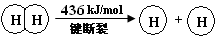
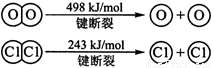
��ش�
��1��H2��O2��Ӧ������̬ˮ���Ȼ�ѧ����ʽ
��2���Ͽ�1 mol H��O ����������ԼΪ kJ
II����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ��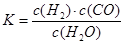 ��������Ӧ�Ļ�ѧ����ʽΪ��
��������Ӧ�Ļ�ѧ����ʽΪ��
��2����֪��400��ʱ��N2 (g)+ 3H2(g)
 2NH3(g)
��H<0 ��K=0.5����400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧv(N2)�� v(N2)���������������������ȷ������1�֣�
2NH3(g)
��H<0 ��K=0.5����400��ʱ����0.5L�ķ�Ӧ�����н��кϳɰ���Ӧ��һ��ʱ����N2��H2��NH3�����ʵ����ֱ�Ϊ2mol��1mol��2mol�����ʱ��Ӧv(N2)�� v(N2)���������������������ȷ������1�֣�
��ʹ�ø÷�Ӧ�Ļ�ѧ��Ӧ���ʼӿ죬ͬʱʹƽ��ʱNH3������ٷ������ӣ��ɲ�ȡ����ȷ��ʩ�� ������ţ���1�֣�
A����С�������ѹǿ B�������¶� C���Ӵ��� D��ʹ����Һ������
��3����һ��������ܱ������У��������»�ѧ��Ӧ��A(g) + 3B(g)  2C(g)
+ D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
2C(g)
+ D��s�� ��H���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
|
t/K |
300 |
400 |
500 |
�� |
|
K/(mol��L��1)2 |
4��106 |
8��107 |
K1 |
�� |
������������⣺
���жϸ÷�Ӧ�Ħ�H 0���>����<���� ��1�֣�
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬���� ������ţ�
A��3v(B)������=2v(C)������ B��A��B��ת�������
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��4������Ȼ��(�������ʲ����뷴Ӧ)Ϊԭ�ϵ�ȼ�ϵ��ʾ��ͼ��ͼ��ʾ��
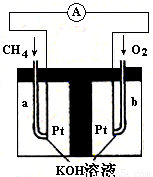
�ٷŵ�ʱ�������ĵ缫��ӦʽΪ
�ڼ���װ����ʢװ100.0 mL 3.0 mol��L��1 KOH��Һ���ŵ�ʱ���뷴Ӧ�������ڱ�״�������Ϊ8 960 mL���ŵ���Ϻ������Һ�и�����Ũ�ȵĴ�С��ϵΪ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��ͬ���� ���ͣ�������ѡ����
 2NH3 (g)
2NH3 (g) �鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com