
某小组以CoCl2·6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X,为确定其组成,进行如下实验。
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10% NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol·L-1的盐酸标准溶液吸收。蒸氨结束后取下接收瓶,用c2 mol·L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液。

②氯的测定:准确称取样品X,配成溶液后用AgNO3标准溶液滴定,K2CrO4溶液为指示剂,至出现淡红色沉淀不再消失为终点(Ag2CrO4为砖红色)。
回答下列问题:
(1)装置中安全管的作用原理是_____________________。
(2)用NaOH标准溶液滴定过剩的HCl时,应使用__________式滴定管,可使用的指示剂为________。
(3)样品中氨的质量分数表达式为________________。
(4)测定氨前应该对装置进行气密性检验,若气密性不好测定结果将________(填“偏高”或“偏低”)。
(5)测定氯的过程中,使用棕色滴定管的原因是___________________;滴定终点时,若溶液中c(Ag+)=2.0×10-5 mol·L-1,c(CrO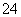 )为________ mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
)为________ mol·L-1。[已知:Ksp(Ag2CrO4)=1.12×10-12]
(6)经测定,样品X中钴、氨和氯的物质的量之比为1∶6∶3,钴的化合价为________。制备X的化学方程式为___________________;
X的制备过程中温度不能过高的原因是______________________________。
答案 (1)当A中压力过大时,安全管中液面上升,使A瓶中压力稳定
(2)碱 酚酞(或甲基红)
(3)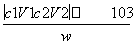 ×100%
×100%
(4)偏低
(5)防止硝酸银见光分解 2.8×10-3
(6)+3 2CoCl2+2NH4Cl+10NH3+H2O2===2[Co(NH3)6]Cl3+2H2O 温度过高过氧化氢分解、氨气逸出
解析 (1)若没有A中的安全管,当A中产生气体时,会因装置压力过大发生危险;反之,有安全管存在,当A中压力过大时,安全管中的液面会上升,使A瓶中压力稳定。
(2)由题意知,用NaOH标准溶液滴定过剩的HCl时,NaOH溶液应放入碱式滴定管中,可使用酚酞作指示剂,滴定至终点时溶液由无色变为浅红色。
(3)已知盐酸的总的物质的量为c1 mol·L-1×V1 mL×10-3 L·mL-1=c1V1×10-3 mol,NH3反应完后剩余的盐酸用NaOH标准溶液滴定,可求出剩余的盐酸为c2×V2×10-3 mol,由NH3+HCl===NH4Cl可求出NH3的物质的量。进而求出w g X中的含氨量,即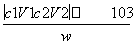 ×100%。
×100%。
(4)若装置气密性不好,会有NH3外逸,而不被HCl吸收,则剩余的HCl的物质的量会增多,消耗NaOH增多,即c2V2的值增大,由(3)中计算式可知氨的测定结果偏低。
(5)AgNO3是见光易分解的物质,使用棕色滴定管的目的是防止AgNO3见光分解而影响实验结果;由Ag2CrO4的溶度积常数Ksp=1.12×10-12,c(Ag+)=2.0×10-5 mol·L-1,可求出c(CrO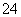 )=
)=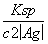 =
=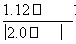 mol·L-1=2.8×10-3 mol·L-1。
mol·L-1=2.8×10-3 mol·L-1。
(6)样品X中钴、氨和氯的物质的量之比为1∶6∶3,可写出化学式为[Co(NH3)6]Cl3,由化合物中正负化合价代数和为0计算,NH3整体为0价,氯为-1价,故Co为+3价;从而推出制备X的化学方程式为2CoCl2+2NH4Cl+10NH3+H2O2===2[Co(NH3)6]Cl3+2H2O。由于温度过高时H2O2易分解、NH3易挥发,故制备过程中温度不能过高。


科目:高中化学 来源: 题型:
已知2SO2(g)+O2(g)??2SO3(g) ΔH=-196.64 kJ·mol-1,在一定温度下,向一固定容积的密闭容器中通入2 mol SO2、1 mol O2,达到平衡时放出热量为Q1 kJ,在同样条件下,向该容器中通入2 mol SO3,达到平衡时,吸收热量为Q2 kJ,则Q1和Q2的关系为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ,下列热化学方程式正确的是( )
A.CH3OH(l)+ O2(g)===CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
O2(g)===CO2(g)+2H2O(l) ΔH=+725.76 kJ·mol-1
B.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-1 451.52 kJ·mol-1
C.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=-725.76 kJ·mol-1
D.2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l) ΔH=+1 451.52 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释10倍,溶液的pH分别变成m和n,则m与n的关系为________。
(2)体积相同,浓度均为0.2 mol·L-1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________________。
(3)体积相同,pH均等于1的盐酸和CH3COOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成3,则m与n的关系为________________。
(4)体积相同,pH均等于13的氨水和NaOH溶液,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n的关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准盐酸溶液滴定未知浓度的NaOH溶液(酚酞作指示剂),用“偏高”、“偏低”或“无影响”填空。
(1)酸式滴定管未用标准溶液润洗( )
(2)锥形瓶用待测溶液润洗( )
(3)锥形瓶洗净后还留有蒸馏水( )
(4)放出碱液的滴定管开始有气泡,放出液体后气泡消失( )
(5)酸式滴定管滴定前有气泡,滴定终点时气泡消失( )
(6)部分酸液滴出锥形瓶外( )
(7)酸式滴定管滴定前读数正确,滴定后俯视读数(或前仰后俯)( )
(8)酸式滴定管滴定前读数正确,滴定后仰视读数(或前俯后仰)( )
查看答案和解析>>
科目:高中化学 来源: 题型:
利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,所用指示剂为________,滴定反应的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是( )
A.柠檬酸的电离会抑制碳酸的电离
B.该碳酸饮料中水的电离受到抑制
C.常温下,该碳酸饮料中Kw的值大于纯水中Kw的值
D.打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于极性键的叙述中不正确的是( )
A.是由不同元素原子形成的共价键
B.共价化合物中必定存在极性键
C.极性键中电负性大的原子显正电性
D.共用电子对必然偏向吸引电子能力强的原子一方
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com