
科目:高中化学 来源: 题型:解答题
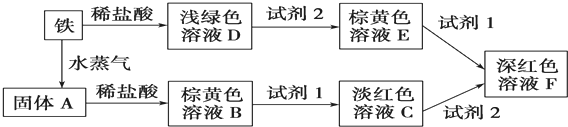
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和Na2SO4溶液可以使蛋白质变性 | |
| B. | 大力推广应用“脱硫、脱硝”技术,可减少硫氧化物、氮氧化物对空气的污染 | |
| C. | 从海带中提取碘单质的过程涉及氧化还原反应 | |
| D. | 镀锌铁桶镀层破损后铁仍不易被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
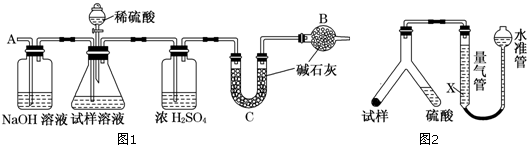
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Mg(HCO3)2溶液中加入过量的NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O | |
| B. | 溴化亚铁溶液中通入足量的氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 少量的CO2通入稀的碳酸钠溶液中:CO2+CO32-+H2O═2HCO3- | |
| D. | 向NH4Al(SO4)2溶液中滴入Ba(OH)2使SO42-反应完全2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12 | B. | 13 | C. | 14 | D. | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
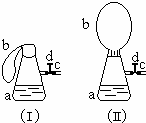 如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:
如图(Ⅰ)中锥形瓶a内放入43.8g10%的稀盐酸,b是未充气的气球,里边放有4g碳酸钙粉末,将它紧紧套在瓶a口上,胶管c套在瓶的侧口,并用弹簧夹d夹紧(瓶口和侧口都不漏气).将图Ⅰ的装置在托盘天平上称量,质量为W1克.根据实验现象填写下列空白:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com