


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |
| 4 | ① | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:
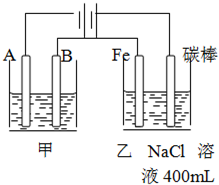 如图为相互串联的甲乙两个电解池,请回答:
如图为相互串联的甲乙两个电解池,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 CrO2Cl2在有机合成中可作氧化剂或氯化剂,能与许多有机物反应,可用重铬酸钾与四氯化碳反应制备:
CrO2Cl2在有机合成中可作氧化剂或氯化剂,能与许多有机物反应,可用重铬酸钾与四氯化碳反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用汽油除去衣服上的油污 |
| B、用餐具洗洁精清洗餐具上的油污 |
| C、用水洗去盘子中的水果渣 |
| D、用醋洗去水壶的水垢 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com