

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减少 | |
| C. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) | |
| D. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C 的体积分数的2倍 |
分析 开始加入4molC和2molD相当于初始加入2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,平衡时同物质的浓度相等,
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,则相当于在原来的基础上增大压强,平衡向逆反应方向移动,平衡时甲中C的浓度小于原来的2倍;
B.保持活塞位置不变,升高温度,平衡向正反应方向移动;
C.甲温度和体积不变,加入氦气后对平衡移动没有影响,保持温度和乙中的压强不变,加入氦气后乙体积增大,平衡应向正反应方向移动,正逆反应速率都减小;
D.保持温度不变,移动活塞P,使乙的容积和甲相等,则乙容器内的压强增大,平衡向逆反应方向移动.
解答 解:开始加入4molC和2molD相当于起始加入2molA和4molB,即乙容器内的气体的物质的量为甲容器内的气体的物质的量的2倍,而乙容器的体积为甲容器的体积的2倍,在相同温度下达到相同平衡状态,平衡时同种物质的浓度相等,
A.保持温度和活塞位置不变,在甲中再加入1molA和2molB,则相当于在原来的基础上增大压强,平衡向逆反应方向移动,达到平衡时,甲中C的浓度小于原来的2倍,即甲中C的浓度小于乙中C的浓度的2倍,故A错误;
B.保持活塞位置不变,升高两个容器的温度,平衡向正反应方向移动,甲、乙中B的体积分数都减小,故B正确;
C.甲中温度和体积不变充入稀有气体,没有改变气体的浓度,对反应速率没有影响,可以用图2表示,乙中温度和压强不变,充入稀有气体,相当于增大容器体积,气体浓度减小,反应速率减小,生成物的浓度减小的程度大些,化学平衡正向移动,可以用图3表示,故C正确;
D.保持温度不变,移动活塞P,使乙的容积和甲相等,则乙容器内的压强增大,平衡向逆反应方向移动,达到新的平衡后,乙中C的体积分数小于甲中C的体积分数的2倍,故D错误;
故选BC.
点评 本题考查化学平衡及其综合应用,题目难度中等,注意从等效平衡的角度分析起始时甲乙两容器内的气体的平衡状态,关键是对等效平衡的理解,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 做衣服的棉、麻和丝分别属于纤维素、酯类和蛋白质 | |
| B. | 不锈钢餐具属于合金 | |
| C. | 在豆浆中加糖后碗底发现少量晶体状颗粒,这是蛋白质的盐析 | |
| D. | 水的硬度越大,用肥皂洗衣服时效果越好 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某溶液中滴加AgNO3溶液有白色沉淀,说明原溶液中有Cl- | |
| B. | 某溶液中先滴足量盐酸无现象,再滴加BaCl2溶液有白色沉淀,说明原溶液中有SO42- | |
| C. | 某溶液中滴加NaOH溶液有蓝色沉淀,说明原溶液中有Fe3+ | |
| D. | 某溶液中滴加稀硫酸生成无色气体,说明原溶液中有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
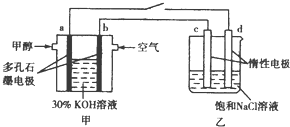 CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5-4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:
CO2是一种温室气体,据科学家预测,到21世纪中叶,全球气温将升高1.5-4.5℃,地球气温的升高会引起海平面升高,对人类的生存环境产生巨大的影响.如何合理地利用CO2是摆在科学家面前的一个重大课题.回答下列问题:| CO2的量 | NaOH溶液的量 | 放出的热量 | |
| ① | 22.0g | 750mL1.0mol•L-1 | xkJ |
| ② | 1.0mol | 2.0mL1.0mol•L-1 | ykJ |
| 物质 | CO2(g) | H2(g) | CH4(g) | H2O(g) |
| 浓度/mol•L-1 | 0.2 | 0.8 | a | 1.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
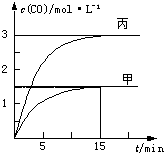 一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )
一定条件下存在反应C(s)+H2O(g)?C O(g)+H2(g):向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如表,反应过程中CO的物质的量浓度随时间变化如图所示.则下列说法正确的是( )| 容 器 | 甲 | 乙 | 丙 |
| 容 积 | 0.5L | 0.5L | V |
| 温 度 | T1℃ | T2℃ | T1℃ |
| 起始量 | 2molC 1molH2O | 1molCO 1molH2 | 4molC 2molH2O |
| A. | 甲容器中,反应在前15min的平均速率v(H2)=0.2mol•L-1•min-1 | |
| B. | 丙容器的体积V>0.5L | |
| C. | 当温度为T1℃时,反应的平衡常数K=4.5(mol•L-1) | |
| D. | 乙容器中,若平衡时n(H2O)=0.4mol,则T1<T2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
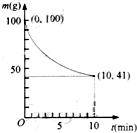 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器Ⅰ、Ⅱ中正反应速率相同 | |
| B. | 容器Ⅰ中的气体颜色比容器Ⅱ中的气体颜色深 | |
| C. | 容器Ⅰ、Ⅲ中反应的平衡常数相同 | |
| D. | 容器Ⅰ中H2的转化率与容器Ⅱ中HI的转化率之和等于1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com