
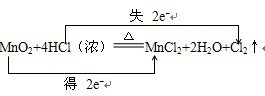
 ,
, ;MnO2;HCl;
;MnO2;HCl;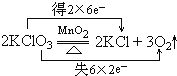 ,
, ;KClO3;KClO3.
;KClO3;KClO3.


科目:高中化学 来源: 题型:
| A、常温下,同浓度一元酸HA比HB易电离,则相同浓度NaA溶液比NaB溶液的pH大 |
| B、0.2 mol/LNH4NO3 和 0.l mol/L NaOH 溶液等体积混合后:c(NH4+)>c (NO3-)>c (Na+)>c (OH-)>c (H+) |
| C、物质的量浓度相等的醋酸溶液和氢氧化钠溶液等体积混合:c (Na+)+c(H+)=c (CH3COO-)+c (OH-)+c (CH3COOH) |
| D、同浓度的下列溶液:①NH4Al(SO4)2②NH4Cl ③NH3?H2O ④CH3COONH4,其中c(NH4+) 由大到小的顺序是:①>②>④>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有吸水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | SO2通入橙黄色的溴水中 | 溶液褪色 | SO2具有还原性 |
| D | 酸性KMnO4溶液滴入H2O2中 | 立即产生气泡 | KMnO4可作H2O2分解的催化剂 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.02mol/(L?min) |
| B、0.04mol/(L?min) |
| C、0.08mol/(L?min) |
| D、0.8mol/(L?min) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | 动植物生长不可缺少的元素,是蛋白质的重要成分 |
| Y | 地壳中含量位居第一位 |
| Z | 短周期中,其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| W | X | Y | Z | |
| 结构 或 性质 |
最高价氧化物是温室气 体,其原子的最外层电子 数是次外层电子数的2 倍 |
最高价氧化物对 应的水化物与其 气态氢化物反应 得到离子化合物 |
氧化物是常见的两性化合物 | 最高正价与最 低负价之和为 零 |
查看答案和解析>>
科目:高中化学 来源: 题型:
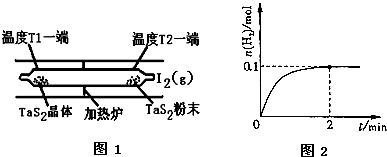
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com