
【题目】(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L1·min1,则以物质B表示此反应的化学反应速率为________mol·L1·min1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为____________________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) ![]() 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
【答案】 0.6 0.05 mol·L1·s1 8.8 0.08 mol·L1
【解析】(1)根据化学方程式中的计量数关系可知![]() =
=![]() ,v(B)=3v(A)=3×0.2 mol·L1·min1=0.6 mol·L1·min1。(2)3 s内消耗的N2的物质的量为2 mol1.9 mol=0.1 mol,根据化学方程式N2+3H2
,v(B)=3v(A)=3×0.2 mol·L1·min1=0.6 mol·L1·min1。(2)3 s内消耗的N2的物质的量为2 mol1.9 mol=0.1 mol,根据化学方程式N2+3H2![]() 2NH3,可以计算出3 s内消耗的H2的物质的量为0.3 mol,根据化学反应速率的计算公式可知v(H2)=
2NH3,可以计算出3 s内消耗的H2的物质的量为0.3 mol,根据化学反应速率的计算公式可知v(H2)= ![]() =0.05 mol·L1·s1。(3)在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则消耗A的浓度是0.06 mol·L1·s1×2s=0.12mol/L,根据方程式可知
=0.05 mol·L1·s1。(3)在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则消耗A的浓度是0.06 mol·L1·s1×2s=0.12mol/L,根据方程式可知
3A(g)+B(g)![]() 2C(g)
2C(g)
起始浓度(mol/L) 1 0.5 0
转化浓度(mol/L) 0.12 0.04 0.08
2s时浓度(mol/L)0.88 0.46 0.08
则在2 s时,容器中A的物质的量是0.88mol/L×10L=8.8mol,此时C的物质的量浓度为0.08molL。


科目:高中化学 来源: 题型:
【题目】已知:3Z(s)![]() X(g)+2Y(g) ΔH=akJ·molˉ1(a>0)。下列说法不正确的是
X(g)+2Y(g) ΔH=akJ·molˉ1(a>0)。下列说法不正确的是
A.将0.3molZ置于容器中充分反应生成气体的物质的量一定小于0.3mol
B.达到化学平衡状态时,气体平均摩尔质量不变
C.达到化学平衡状态时,反应放出的总热量可达akJ
D.升高反应温度,逆反应速率增大,正反应速率也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当氨分子中的三个氢原子依次被其它原子或基团取代时,所形成的化合物叫做氨的衍生物。主要有N2H4(肼)、HN3(叠氮化氢,溶于水称为叠氮酸)、NH2OH(羟胺)。水合肼(N2H4·H2O)是制备叠氮化钠(NaN3)的原料,而叠氮化钠又是汽车安全气囊最理想的气体发生剂的原料。下面是工业水合肼法制备叠氮化钠的工艺流程。
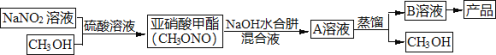
资料:①水合肼有毒且不稳定,具有强还原性和强碱性;
②有关物质的物理性质如下表:
物质 | 甲醇 | 水合肼 | 亚硝酸甲酯 | 叠氮化钠 |
熔点(℃) | -97 | -40 | -17 | 275(410℃:易分解) |
沸点(℃) | 64.7 | 118.5 | -12 | — |
回答下列问题:
I.合成水合肼。实验室合成水合肼装置如下图所示,NaClO碱性溶液与尿素CO(NH2)2水溶液在400C以下反应一段时间后,再迅速升温至1100℃继续反应可以制得水合肼。
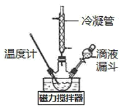
(1)实验中通过滴液漏斗向三颈瓶中缓慢滴加NaClO碱性溶液,不能反向滴加的原因是______________;制取N2H4H2O的离子方程式为_______________________。
II.制备叠氮化钠。实验室可利用下图中所示的装置及药品制备叠氮化钠。
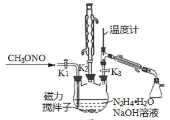
(2)①根据实验发现温度在20℃左右反应的转化率最高,因此可釆取的措施是_______________;流程中蒸馏A溶液时,装置中旋塞K1、K2、K3的开关情况是_______________________。
②写出该方法制备叠氮化钠的化学方程式:________________________。
(3)流程中由B溶液获得叠氮化钠产品的实验步骤为____________________,减压过滤,晶体用乙醇洗涤23次后,干燥。
(4)化工生产中,多余的叠氮化钠常使用次氯酸钠溶液处理,在酸性条件下,二者反应可生成无毒的气体。若处理6.5gNaN3,理论上需加入0.5molL的NaClO溶液_____________mL。
III.羟胺(NH2OH)是一种还原剂,可以通过下列过程得到:乙烯和N2O4气体混合后,光照,发生加成反应,得到化合物A。A结构对称,所有相同元素的原子化学环境相同。A在某浓度的硫酸溶液中回馏,可得到化合物B,同时得到CO和CO2组成的混合气体(相对氢气密度为18)。经分析,B为不含碳元素的硫酸盐,其硫和氧元素的质量分数分别为19.51%和58.54%。若将A换成CH3CH2NO2进行类似的反应,也能得到B,但没有气体放出。B在液氨中即得到NH2OH。
(5)NH2OH具有弱碱性,可与酸反应生成盐,该盐阳离子的电子式为_______________。
(6)写出A→B的化学方程式________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅的冶炼有很多种方法。
(1)瓦纽科夫法熔炼铅,其相关反应的热化学方程式如下:
① 2PbS(s)+3O2(g)=2PbO(s)+2SO2(g) ΔH1=a kJ·mol-1
② PbS(s)+2PbO(s)=3Pb(s)+SO2(g) ΔH2=b kJ·mol-1
③ PbS(s)+PbSO4(s)=2Pb(s)+2SO2(g) ΔH3=c kJ·mol-1
反应PbS(s)+2O2(g)=PbSO4(s) ΔH=______________ kJ·mol-1(用含a、b、c的代数式表示)。
(2)还原法炼铅,包含反应PbO(s)+CO(g)![]() Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
Pb(s)+CO2(g) ΔH,该反应的平衡常数的对数值与温度的关系如下表:
温度/℃ | 300 | 727 | 1227 |
lgK | 6.17 | 2.87 | 1.24 |
①该反应的ΔH_______0(选填“>”、“<”或“=”)。
②当lgK=1,在恒容密闭容器中放入PbO并通入CO,达平衡时,混合气体中CO的体积分数为______________ (保留两位有效数字);若向容器中充入一定量的CO气体后,平衡向_________ (填“正向”、“逆向”或“不”)移动,再次达到平衡时,CO的转化率_________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合H+能力由大到小的顺序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释醋酸,下列各式表示的数值随水量的增加而增大的是______(填字母)。
a.c(CH3COOH)/c(H+) b. c(CH3COO-)/c(CH3COOH) c. c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
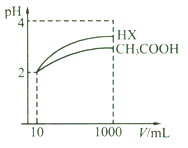
则HX的电离平衡常数________(填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
(6)25℃时,测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是 ( )

A. X、Y、Z三种元素中,X的非金属性最强
B. 常压下X的单质的熔点比Z的低
C. Y的最高正化合价为+7
D. Y的氢化物的稳定性比Z的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。
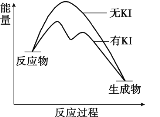
t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由 N乙烯基吡咯烷酮(NVP)和甲基丙烯酸 β羟乙基(HEMA)合成水凝胶材料高聚物A 具有较高的含水量,其路线如下图所示:
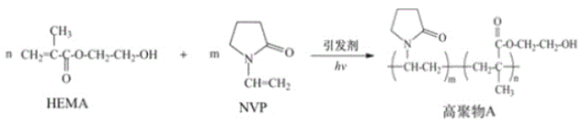
下列说法不正确的是
A.HEMA 的水解产物均可用作聚合反应的单体
B.高聚物A 因含有多个—OH 而具有良好的亲水性
C.HEMA 和 NVP 通过缩聚反应生成高聚物 A
D.若将高聚物A 与足量HOOC(CH2)4COOH 反应,可能通过形成新的酯基,进而交联形成网状结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pKa=-lgKa,25 ℃时,H2SO3的pKa1=1.85,pKa2=7.19。常温下,用0.1 mol·L-1 NaOH溶液滴定20 mL 0.1 mol·L-1 H2SO3溶液的滴定曲线如图所示。下列说法不正确的是
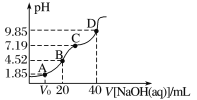
A.C点所得溶液中:c(Na+)>3c(![]() )
)
B.D点所得溶液中水解平衡常数Kh1=10- 6.81
C.A点所得溶液中:V0等于10 mL
D.B点所得溶液中:c(Na+)+c(H+)=2c(![]() )+c(
)+c(![]() )+c(OH-)
)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com