
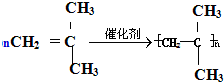
 ,
, ;
; ;
; ;
;| 催化剂 |
| 催化剂 |


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
 ,其余为-Cl,则X分子中-Cl的数目可能是( )
,其余为-Cl,则X分子中-Cl的数目可能是( )| A、a+2-m |
| B、2n+3a-m |
| C、n+m+a |
| D、a+2n+2-m |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X、W能形成共价化合物 |
| B、Z、W能形成离子化合物 |
| C、Y分子中存在共价键 |
| D、Y和Z不能形成化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED).目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主.已知砷化镓的晶胞结构如图.试回答:
2013年绵阳科博会场馆,大量的照明材料或屏幕都使用了发光的二极管(LED).目前市售LED铝片,材质基本以GaAs(砷化镓)、AlGaInP(氮化铟镓)为主.已知砷化镓的晶胞结构如图.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)元素的第一电离能:Al
(1)元素的第一电离能:Al查看答案和解析>>
科目:高中化学 来源: 题型:
 铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.
铜在化合物中的常见化合价有+l、+2 等,故能形成多种铜的化合物.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com