
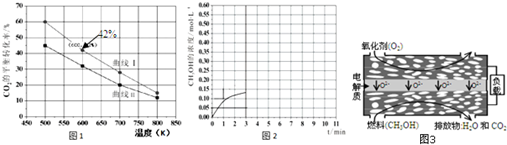
分析 (1)依据热化学方程式和盖斯定律计算得到所需热化学方程式;正反应如果是吸热反应升高温度平衡正向移动;
(2)①图象分析相同温度下,两种反应物,增大一种物质的量会提高另一种物质的转化率;
②a.结合三行式进行计算,化学反应的平衡常数K各个生成物平衡浓度系数次方的乘积和各个反应物平衡浓度系数次方乘积的比值,据此计算;
b.将体系温度升至600K,根据升高温度,平衡向着吸热方向来进行回答;
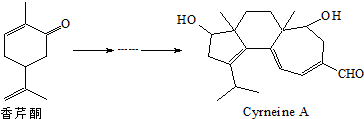
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲烷失电子发生氧化反应,结合导电离子和电荷守恒分析书写;
②依据电极反应计算转移电子数,结合法拉第常数为9.65×104C•mol-1计算电量.
解答 解:(1)反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反应Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
根据盖斯定律,反应Ⅱ可以是Ⅰ-Ⅲ得到,所以反应Ⅱ的焓变△H2=(-49.58kJ•mol-1)-(-90.77kJ•mol-1)=+41.19 kJ•mol-1;根正反应是吸热反应升高温度平衡正向移动,
故答案为:+41.19 kJ•mol-1;正向;
(2)①A:n(H2)=3mol,n(CO2)=1.5mol,B:n(H2)=3mol,n(CO2)=2mol,二者比较B相当于增大二氧化碳的量,转化率小于A,所以曲线Ⅱ代表B的投料,
故答案为:B;
②在温度为500K的条件下,充入3mol H2和1.5mol CO2,该反应10min时达到平衡,二氧化碳的转化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始浓度:0.5 1 0 0
变化浓度:0.3 0.9 0.3 0.3
平衡浓度:0.2 0.1 0.3 0.3
a.该温度下,反应I的平衡常数K=$\frac{0.3×0.3}{0.2×0.{1}^{3}}$=450,
500K时,若在此容器中开始充入0.3molH2和0.9mol CO2、0.6molCH3OH、xmolH2O,浓度分别为0.1mol/L,0.3mol/L,0.2mol/L,$\frac{x}{3}$mol/L
若使反应在开始时正向进行,浓度商Qc=$\frac{0.2×\frac{x}{3}}{0.3×0.{1}^{3}}$<K=450
x=2.025
则x应满足的条件是0<x<2.025
故答案为:450,0<x<2.025;
b.当反应时间达到3min时,迅速将体系温度升至600K,则平衡正向进行,甲醇的浓度会增加,图象为,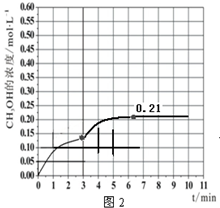
故答案为: ;
;
(3)①以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,分析该电池的工作原理如图3所示可知负极是甲烷失电子发生氧化反应,结合导电离子和电荷守恒分析书写电极反应为:CH3OH-6e-+3O2-=CO2↑+2H2O,
故答案为:CH3OH-6e-+3O2-=CO2↑+2H2O;
②16g甲醇物质的量=$\frac{16g}{32g/mol}$=0.5mol,发生反应时电子转移0.5mol×6=3mol,则理论上提供的电量最多为3mol×9.65×104C•mol-1=2.895×105 C,
故答案为:2.895×105 C.
点评 本题综合考查学生盖斯定律的应用、化学反应速率的计算、化学平衡移动的影响因素等知识,属于综合知识的考查,难度较大.


科目:高中化学 来源: 题型:选择题
| 操 作 | 现 象 | 结 论 | |
| A | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| B | 将一片铝箔置于酒精灯外焰上灼烧 | 铝箔熔化 但不滴落 | 铝箔表面有致密Al2O3薄膜,且Al2O3熔点高于Al |
| C | 无色溶液中滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| D | 向溶液X中加入稀盐酸,并将产生的无色无味气体通入澄清石灰水中 | 生成白色沉淀 | 溶液X中可能含有 CO32-或 HCO3- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向NaClO溶液中滴入少量FeSO4溶液:2Fe2++ClO-+2H+=Cl-+2Fe3++H2O | |
| B. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-=2Fe2++I2+3H2O | |
| C. | 碳酸氢钠溶液与少量澄清石灰水反应:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O | |
| D. | Na2SO3溶液中SO32-的水解:SO32-+H2O$\frac{\underline{\;电解\;}}{\;}$HSO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 香芹酮化学式为C9H12O | |
| B. | Cyrneine A可以发生加成反应、消去反应和氧化反应 | |
| C. | 香芹酮和Cyrneine A均能使酸性KMnO4溶液褪色 | |
| D. | 香芹酮和Cyrneine A可以通过氯化铁溶液鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时铅蓄电池负极电池反应 PbO2+4H++SO42-+2e-═PbSO4+2H2O | |
| B. | 充电时蓄电池阴极电极反应 PbSO4+2e-═Pb+SO42- | |
| C. | 用铅蓄电池来电解CuSO4溶液,要生成1.6g Cu,则该电池内部要消耗0.025mol H2SO4 | |
| D. | 铅蓄电池充电时,若要使3.03kg PbSO4转变为Pb和PbO2,则需要通过20mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (-R、-R′代表烃基或氢原子)
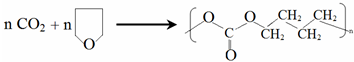
(-R、-R′代表烃基或氢原子) 的单体是CO2和
的单体是CO2和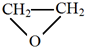 .
.
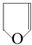
 ,名称是1,3-丁二烯.
,名称是1,3-丁二烯.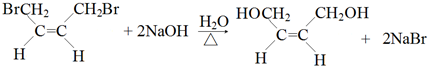 .
. .
. .
. .
.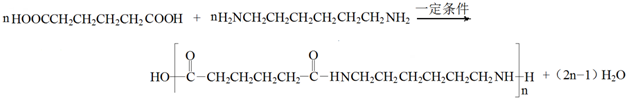 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
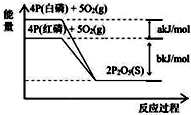
| A. | 4P(白磷)+5O2(g)═2P2O5(S);△H1=+(a+b)kJ/mol | |
| B. | 4P(红磷)+5O2(g)═2P2O5(S);△H2=-(b)kJ/mol | |
| C. | 4P+5O2═2P2O5(s);△H3=+(a+b)kJ/mol | |
| D. | P(白磷)═P(红磷);△H4=+(a)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸馏时,在烧瓶中加几粒沸石 | |
| B. | 加液时,胶头滴管悬置在试管正上方 | |
| C. | 萃取时,分液漏斗正立振荡后,直接放在铁架台上,静置 | |
| D. | 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO+H2$\frac{\underline{\;高温\;}}{\;}$Cu+H2O | B. | CO2+Ca(OH)2$\frac{\underline{\;点燃\;}}{\;}$CaCO3↓+H2O | ||
| C. | Fe2O3+3CO═2Fe+3CO2 | D. | 2Na+Cl2═2NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com