
若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,则元素周期表中第三、第四、第五周期含有的元素分别有( )
A. 5种、10种、15种 B. 8种、18种、18种
C. 8种、10种、15种 D. 9种、10种、15种
考点: 原子核外电子排布;元素周期表的结构及其应用.
专题: 元素周期律与元素周期表专题.
分析: 元素周期表的周期数等于原子核外电子层数,各电子层电子的最大容量为2n2,则每层电子数最多为2、8、18、32、50等排列,最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,第一周期有2种元素,第2周期有5种元素,第3周期最后一种元素的原子的核外电子数分别为2、8、5,第4周期最后一种元素的原子的核外电子数分别为2、8、10、5,第5周期最后一种元素的原子的核外电子数分别为2、8、15、10、5,以此解答该题.
解答: 解:若原子核外电子的排布的基本规律为最外层电子数不超过5个,次外层电子数不超过10个,倒数第三层电子数不超过15个,而各电子层电子的最大容量仍为2n2,
则周期表中每一周期最后一种元素的核外电子排布分别为:
第1周期:2;
第2周期:2、5;
第3周期:2、8、5;
第4周期:2、8、10、5;
第5周期:2、8、15、10、5,
则元素周期表中第三、第四、第五周期含有的元素分别有8、10、15种,
故选C.
点评: 本题考查元素核外电子排布和原子周期表的关系,侧重于学生的分析能力和自学能力的考查,注意把握题给信息,为解答该题的关键,根据周期表中每一周期最后一种元素的核外电子排布判断,题目难度中等.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
金属汞在加热条件下可以与氧气化合生成氧化汞,反应如下:2Hg+O2=2HgO,下列哪个选项可以说明0.3mol Hg 与0.1mol O2 充分反应后物质的种类及其量的情况?( )
|
| A. | 0.2molHgO+0.1molHg | B. | 0.2molHgO |
|
| C. | 0.2molHgO+0.1molO2 | D. | 0.1molHgO+0.1molHg |
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ实验室进行实验①制乙烯②制溴苯③石油分馏④银镜反应
(1)不需要加热的有 ;
(2)需要水浴的有 ;
(3)需要加碎瓷片的有 ;
(4)反应中必须加入浓H2SO4的有 ;(填序号)
Ⅱ现有:A.(CH3)3CCl;B.(CH3)3CCH2Cl;C.(CH3)2CHCl;D.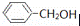 四种有机物
四种有机物
(1)能水解生成醇的是 ;(填字母)
(2)不能消去成烯的是 ;(填字母)
(3)D与甲酸发生酯化反应的产物是 .(写分子式)
查看答案和解析>>
科目:高中化学 来源: 题型:
宋代著名法医学家宋慈的《洗冤集录》中有﹣银针验毒的记载,“银针验毒”的原理是 4Ag+2H2S+O2═2X+2H2O,下列说法正确的是( )
A. X的化学式为AgS
B. 银针验毒时,空气中氧气失去电子
C. 反应中Ag和H2S均是还原剂
D. 每生成1mo1X,反应转移2mo1 e﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组反应中,硝酸既表现了氧化性,又表现了酸性的是( )
A. C+HNO3 B. SO2+HNO3 C. Fe(OH)3+HNO3 D. FeO+HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A. 石灰石溶于盐酸:CO32﹣+2H+═H2O+CO2↑
B. Al2O3粉末溶于NaOH溶液中:Al2O3+2OH﹣=2AlO2﹣+H2O
C. 硫酸氢钠溶液与氢氧化钡溶液的反应:Ba2++SO42﹣=BaSO4↓
D. 氧化钠加入盐酸中:O2﹣+2H+═H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
目前人类已发现几千万种物质,对物质进行分类,有利于我们的学习.下列物质的分类不正确的是( )
|
| A. | SO2(氧化物) | B. | 碘酒(单质) | C. | HNO3(含氧酸) | D. | 氯水(混合物) |
查看答案和解析>>
科目:高中化学 来源: 题型:
根据如图海水综合利用的工业流程图,判断下列说法正确的是( )已知:MgCl2•6H2O受热生成Mg(OH)Cl和HCl气体等
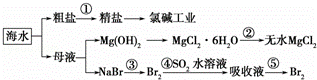
A. 除去粗盐中杂质(Mg2+、SO42﹣、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B. 在过程②中将MgCl2•6H2O灼烧即可制得无水MgCl2
C. 从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D. 从第③步到第⑤步的目的是为了浓缩
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com