
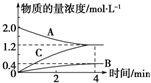
 如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:
如图,曲线表示在800℃时和某反应有关的物质A、B、C的物质的量浓度从开始反应至4min时的变化图象,试回答:分析 (1)随反应进行,反应物的浓度降低,生成物的浓度增大,据此结合图象判断;
(2)根据浓度变化量之比等于化学计量数之比确定化学计量数,t是达到平衡状态,为可逆反应,据此书写方程式;
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,根据v=$\frac{△c}{△t}$计算A物质的平均反应速率.
解答 解:(1)由图可知,随反应进行A的浓度降低,A为反应物,B、C的浓度增大,故B、C为生成物,
故答案为:A;
(2)由图可知,△c(A)=)=2.0mol/L-1.2mol/L=0.8mol/L,△c(B)=0.4mol/L,△c(C)=1.2mol/L,A、B、C化学计量数之比等于浓度变化量之比为0.8mol/L:0.4mol/L:1.2mol/L=2:1:3,反应为可逆反应,故反应方程式为2A$\frac{\underline{\;800℃\;}}{\;}$B+3C,
故答案为:2A$\frac{\underline{\;800℃\;}}{\;}$B+3C;
(3)由图可知△c(A)=2.0mol/L-1.2mol/L=0.8mol/L,所v(A)=$\frac{0.8mol/L}{4min}$=0.2mol/(L•min),
故答案为:0.2mol/(L•min).
点评 本题考查化学反应速率、浓度-时间图象等,注重基础,旨在考查学生对基础知识的掌握,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | a极为负极,b极为正极 | |
| B. | 放电过程中,a、b电极上均发生氧化还原反应 | |
| C. | 该电池工作时添加甲醇的一极,附近溶液的 pH 降低,反应的离子方程式为:CH3OH+8OH--6e-═CO32-+6H2O | |
| D. | 若用此电源电解饱和食盐水,每消耗 0.1molO2则阳极理论上生成 0.2molCl2. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:H2O>H2S>SiH4 | |
| B. | 离子半径:Cl->O2->Mg2+ | |
| C. | 物质酸性:H3PO4>H2SO4>HClO4 | |
| D. | 熔点:KCl>K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶使用前用1.0 mol•L-1的NaOH溶液润洗 | |
| B. | 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒 | |
| C. | 容量瓶内有少量水 | |
| D. | 用敞口容器称量NaOH且时间过长 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 能量(kJ) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
| A. | 放出248 kJ 热量 | B. | 吸收248 kJ 热量 | C. | 放出183kJ 热量 | D. | 吸收183 kJ 热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.
用二氧化氯(ClO2)、高铁酸钠(Na2FeO4摩尔质量为166g•mol-1)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl-和Fe3+.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com