
 ,现进行如下实
,现进行如下实 验:
验: 液中肯定存在的离子是__________ _______,肯定不存在的离子是________ _____。
液中肯定存在的离子是__________ _______,肯定不存在的离子是________ _____。 逐步书写出②中发生反应的离子反应方程式
逐步书写出②中发生反应的离子反应方程式科目:高中化学 来源:不详 题型:单选题
| A.H+、ClO-、Ba2+、HCO3-能在水溶液中大量共存 |
| B.Mg2+、NH4+、Fe2+、NO3-能在酸性溶液中大量共存 |
| C.Fe3+、K+、SCN-、Cl-能大量共存且溶液显红色 |
| D.Na+、NO3-、CO32-、SO32-能在碱性溶液中大量共存 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+ 、H+、SO42-、HCO3- |
| B.Cu2+、SO42-、Ba2+、Cl- |
| C.Na+、 K+、Cl-、 NO3- |
| D.Fe2+、NO3-、Cl-、H+、 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
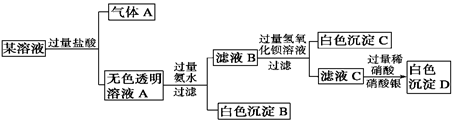
| A.原溶液中一定存在Na+、AlO2-、CO32-、SO42-离子 |
B.气体A的化学式是CO2,其电子式为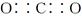 |
| C.原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+ |
| D.生成沉淀B的离子方程式为:Al3++3OH-===Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用pH试纸测定氯水的pH |
| B.过滤时为了加快过滤速度,可以用玻璃棒小心搅拌 |
C.选择合适的试剂,用右图所示装置可分别制取少量CO2和O2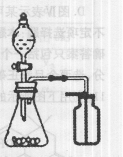 |
| D.室温下向苯和苯酚的混合溶液中加入浓溴水,充分反应后过滤,可除去苯中少量苯酚 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.HCl→H2SO4→H2S→NaOH→CO2 |
| B.NaCl→Na2SO4→NaOH→H2S→CO2 |
| C.Na2S→Na2SO4→NaCl→NaOH→CO2 |
| D.Na2SO4→HCl→H2S→NaOH→CO2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、Ca2+、ClO—、CH3COO— | B.Fe3+、NH+4、SCN-、NO—3 |
| C.H3O+、NO—3、Fe3+、Na+ | D.Al3+、K+、SO2-4、HCO—3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
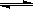 H++OH- KW=10-14 CH3COOH
H++OH- KW=10-14 CH3COOH 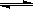 H++ CH3COO- Ka=1.8×10-5
H++ CH3COO- Ka=1.8×10-5查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com