
| 0.6mol-0.1mol |
| 2 |
| 2.24L |
| 22.4L/mol |
| 0.6mol-0.1mol |
| 2 |
| 0.2 |
| 3 |
| 0.2 |
| 3 |
| 0.2 |
| 3 |
| 3 |
| 2 |
| 3.36L |
| 22.4L/mol |


 优等生题库系列答案
优等生题库系列答案科目:高中化学 来源: 题型:
A、基态碳原子的价电子排布图: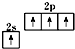 |
| B、HClO的结构式:H-Cl-O |
| C、基态26Fe的价电子排布式:3d64s2 |
D、基态铜原子的价电子排布图: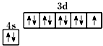 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用碘水鉴别苯、四氯化碳、乙醇三种无色液体 |
| B、取0.2mol NaCl固体于烧杯中,加入200 mL蒸馏水充分搅拌可配成1mol/L的NaCl溶液 |
| C、测定溶液的酸碱性时,应先将pH试纸润湿,然后进行检测 |
| D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量应相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在淀粉溶液中加稀硫酸充分反应后,再加入银氨溶液,可检验淀粉的水解产物 |
| B、用溴水可以鉴别苯、乙醇、四氯化碳三种液体 |
| C、除去苯中的苯酚,可加入NaOH溶液后再分液 |
| D、将氯乙烷与NaOH的乙醇溶液共热,将产生的气体直接通入酸性高锰酸钾溶液中,溶液褪色,证明氯乙烷发生了消去反应. |
查看答案和解析>>
科目:高中化学 来源: 题型:
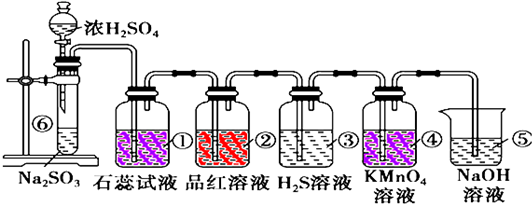
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Al3+、Na+、HCO3-、Cl- |
| B、Fe3+、NO3-、Cl-、SO42- |
| C、Na+、H+、SO32-、NO3- |
| D、SiO32-、Na+、K+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定含有碳、氢两种元素 |
| B、一定含有氧元素 |
| C、该物质为有机化合物 |
| D、氢元素的质量分数为20% |
查看答案和解析>>
科目:高中化学 来源: 题型:
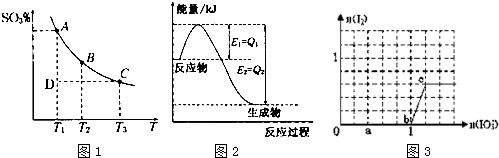
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com