
取x g铜镁合金完全溶于浓硝酸中,反应过程中硝酸被还原只产生8 960 mL的NO2气体和672 mL的N2O4气体(都已折算到标准状态),在反应后的溶液中加入足量的氢氧化钠溶液,生成沉淀质量为17.02 g。则x等于 ( )
A.8.64 B.9.20
C.9.00 D.9.44
科目:高中化学 来源: 题型:
(2011·北京理综,11)下列实验方案中,不能测定Na2CO3和NaHCO3混合物中Na2CO3质量分数的是 ( )
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体
查看答案和解析>>
科目:高中化学 来源: 题型:
普伐他汀是一种调节血脂的药物,其结构如图。下列关系普伐他汀的性质描述不正确的是( )
A.能与FeCl3溶液发生显色反应
B.能使酸性KMnO4溶液褪色
C.能发生加成、取代、消去反应
D.1mol该物质在溶液中最多可与2molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
[选修2——化学与技术] (15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
A.氨水 B.硫化氢气体 C.硫酸钠溶液 D.纯碱溶液
II、合成氨的流程示意图如下:
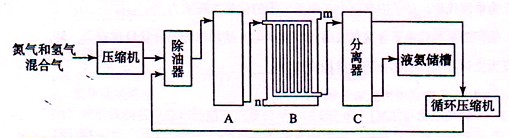
回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ,
;
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3) 设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4) 设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g) 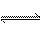 CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
查看答案和解析>>
科目:高中化学 来源: 题型:
按要求书写方程式:
(1)已知将浓盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。在一氧化还原反应的体系中,共有KCl、Cl2、浓H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质。
①写出一个包含上述七种物质的氧化还原反应方程式,并配平__________________。
②在反应后的溶液中加入NaBiO3(不溶于冷水),溶液又变为紫红色,BiO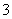 反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_____________________________。
反应后变为无色的Bi3+。写出该实验中涉及反应的离子方程式_____________________________。
(2)+6价铬的毒性很强,制取红矾钠后的废水中含有的Cr2O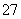 ,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式________________________________________________________________________
,可以用绿矾除去。测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。写出该反应的离子方程式________________________________________________________________________
________________________________________________________________________。
(3)KMnO4的氧化性随pH的减小而增大,在酸性介质中还原产物是Mn2+;在中性或碱性介质中还原产物主要是MnO2。三氯乙烯(C2HCl3)是地下水有机污染物的主要成分,研究显示在地下水中加入KMnO4溶液可将其中的三氯乙烯除去,氧化产物只有CO2,写出反应的化学方程式______________________________________________________
________________________________________________________________________。
(4)已知:①MnO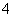 +e-―→MnO
+e-―→MnO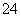 (绿色)(强碱性条件)
(绿色)(强碱性条件)
②MnO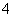 +8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)
+8H++5e-―→Mn2+(无色)+4H2O(强酸性条件)
将KMnO4溶液滴入NaOH溶液中微热,得到透明的绿色溶液,写出反应的离子方程式________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(2013·上海,22)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO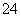 )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 ( )
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0 g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V可能为 ( )
A.9.0 L B.13.5 L
C.15.7 L D .16.8 L
.16.8 L
查看答案和解析>>
科目:高中化学 来源: 题型:
(NH4)2PtCl6晶体受热分解,生成氮气、氯化氢、氯化铵和金属铂,在此分解反应中,氧化产物与还原产物的物质的量之比是 ( )
A.2∶3 B.3∶2 C.4∶3 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是
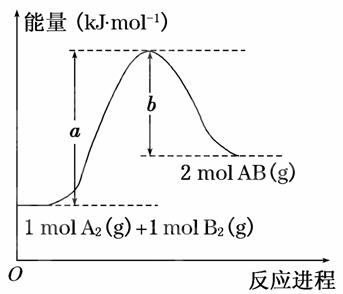
A.每生成2分子AB吸收b kJ热量
B.断裂1 mol A—A和1 mol B—B键,放出a kJ能量
C.该反应中反应物的总能量高于生成物的总能量
D.该反应热ΔH=+(a-b)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的物质是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al ⑤(NH4)2CO3
A.全部 B.①②③ C.①②③⑤ D.②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com