
| A. | 空气 | B. | 氨水 | C. | 磁铁矿 | D. | 冰水共存物 |
分析 纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质,据此结合常见物质的组成成分逐项分析即可.
解答 解:A.空气的成分按体积计算,大约是:氮气占78%、氧气占21%、稀有气体占0.94%、二氧化碳占0.03%、其它气体和杂质占0.03%,所以是混合物,故A错误;
B.氨水中的溶质为NH3,氨气溶于水,与水反应生成NH3•H2O,NH3•H2O电离生成OH-,氨水中存在H2O、NH3、NH3•H2O三种分子,存在H+、OH-、NH4+三种离子,所以是混合物,故B错误;
C.磁铁矿含有四氧化三铁、碳酸钙等多种物质,属于混合物,故C错误;
D.冰是水的固态形式,冰水混合物,只含有一种物质,属于纯净物.故D正确;
故选D.
点评 本题考查了纯净物和混合物的区别,抓住物质是由几种物质组成的,如果只有一种物质组成就属于纯净物,如果有多种物质就属于混合物是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键,可能含共价键,共价化合物中只含共价键绝不含有离子键 | |
| B. | 单质分子中均存在化学键,且只含有共价键,不可能含有离子键 | |
| C. | 共价化合物中可能含非极性共价键,离子化物中不可能含非极性共价键 | |
| D. | 共价化合物中可能含离子键,离子化合物中只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
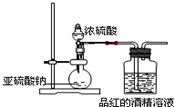 为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)
为探究SO2的漂白是SO2直接作用于有色物质,还是SO2与水反应的产物的作用,设计如图装置进行实验:(图中所用硫酸的质量分数为70%)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; .
. ;
; .
. →
→ ;
;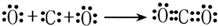 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | =8.4 | B. | >8.4 | C. | <8.4 | D. | ≤8.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
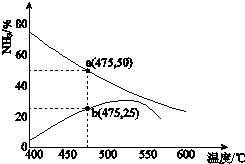 自然界中氮元素有多种存在形式
自然界中氮元素有多种存在形式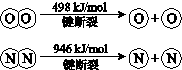
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
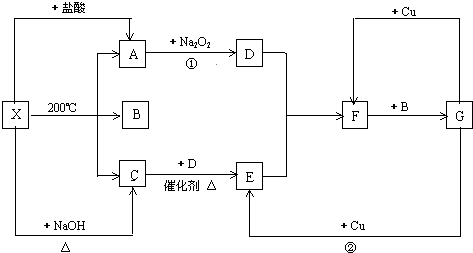
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
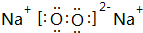 ,其中含有的化学键为离子键和共价键.
,其中含有的化学键为离子键和共价键.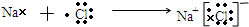 .
. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com