
有关电化学知识的描述正确的是 ( )。
A.理论上说,任何能自发进行的氧化还原反应都可设计成原电池
B.某原电池反应为Cu+2AgNO3===Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液
C.因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中组成原电池,必是铁作负极,铜作正极,其负极反应式为Fe-2e-===Fe2+
D.由Al、Mg与氢氧化钠溶液组成的原电池,其负极反应式为Mg-2e-+
2OH-===Mg(OH)2
科目:高中化学 来源: 题型:
口香糖中常用木糖醇作甜味剂,木糖醇可以防止龋齿,木糖醇的结构简式为
 ,下列有关木糖醇的说法中,正确的是 ( )
,下列有关木糖醇的说法中,正确的是 ( )
A.木糖醇是一种单糖,不能发生水解反应
B.木糖醇能发生酯化反应
C.木糖醇在口腔中易被氧化为酸
D.木糖醇脱去三分子水可得糖醛,结构简式如下图所示

查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,下列说法不正确的是 ( )。

A.反应过程(1)的热化学方程式为 A2 (g)+B2(g)===C(g) ΔH1=-Q kJ·mol-1
B.反应过程(2)的热化学方程式为C(g)===A2(g)+B2(g) ΔH2=+Q1 kJ·mol-1
C.Q与Q1的关系:Q>Q1
D.ΔH2>ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,1 mol 化学键分解成气态原子所需要的能量用E表示。结合表中信息判断下列说法不正确的是 ( )。
| 共价键 | H—H | F—F | H—F | H—Cl | H—I |
| E(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
A.432 kJ·mol -1>E (H-Br)> 298 kJ·mol-1
B.表中最稳定的共价键是 H—F键
C.H2(g)―→2H (g) ΔH= + 436 kJ·mol-1
D.H2 (g)+F2===2HF(g) ΔH=-25 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
选用下列试剂和电极:稀 H2 SO4、Fe2(SO4)3溶液、铁棒、铜棒、铂棒,组成如图所示的原电池装置(只有两个电极),观察到电流计Ⓖ的指针均明显偏转,则其可能的组合共有 ( )。
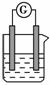
A.6种 B.5种
C.4种 D.3种
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)观察如图所示的两个装置,图1装置中铜电极上产生大量的无色气泡,图2装置中铜电极上无气体产生,而铬电极上产生大量的有色气体。根据上述现象试推测金属铬具有的两种重要化学性质为
________________________________________________________________。

(2)如图是甲烷燃料电池原理示意图,回答下列问题:
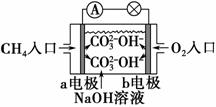
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为________________________________________________________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
研究发现,可以用石墨作阳极、钛网作阴极、熔融的CaF2-CaO作电解质,利用如图所示装置获得金属钙,并以钙为还原剂还原二氧化钛制备金属钛。下列说法中,正确的是 ( )。

A.由TiO2制得1 mol金属Ti,理论上外电路通过2 mol电子
B.阳极的电极反应式为C+2O2--4e-===CO2↑
C.在制备金属钛前后,整套装置中CaO的总量减少
D.若用铅蓄电池作该装置的供电电源,“+”接线柱应连接Pb电极
查看答案和解析>>
科目:高中化学 来源: 题型:
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)氧化—还原法消除氮氧化物的转化如下: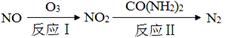
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:NO2(g)+SO2(g)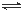 SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)
SO3(g)+NO(g) △H=-41.8 kJ·mol-1已知:2SO2(g)+O2(g)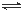 2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
2SO3(g) △H=-196.6 kJ·mol-1,写出NO和O2反应生成NO2的热化学方程式 。
某化学兴趣小组构想将NO转化为HNO3,装置如下图一,电极为多孔惰性材料。则负极的电极反应式是 。
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g);
CH3OCH3(g)+3H2O(g);
①该反应平衡常数表达式为K= 。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图二所示。该反应的ΔH________(填“>”、“<”或“=”)0。
(5)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图三所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
CH3OH(g) △H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图三所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是 ;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
由乙烯合成有机物F(二乙酸乙二酯),采用下列合成路线:
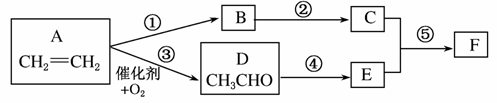
(1)已知有机物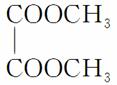 的名称为乙二酸二甲酯。请写出F的结构简式__________。
的名称为乙二酸二甲酯。请写出F的结构简式__________。
(2)在上述反应中属于取代反应的有________(填反应代号)。
(3)A、D、E、F中能引入C中官能团的物质有__________(填反应物代号),其反应⑤的化学方程式为__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com