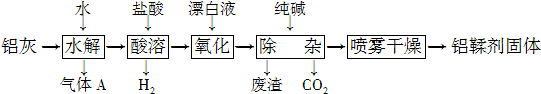
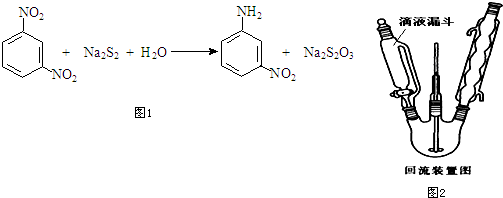
6.间硝基苯胺(Mr=128)是一种重要的染料中间体.它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇.间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,其反应式如图1:
已知:R-NH
2+H
+→R-NH
3+实验步骤:
①在100mL锥形瓶中加入8g结晶硫化钠与30mL水,搅拌溶解.再加入2g硫黄粉,缓缓加热并不断搅拌到硫黄粉全部溶解,冷却后备用.
②在150mL三颈烧瓶中加入4.74g间二硝基苯(Mr=158)与40mL水,安装机械搅拌装置、滴液漏斗和回流冷凝管如图2所示,将步骤①配制的多硫化钠溶液加入滴液漏斗.
③加热三颈烧瓶至瓶内微微沸腾,开动搅拌使间二硝基苯与水形成悬浮液.慢慢滴加多硫化钠溶液,滴加完毕后继续搅拌回流30min.移去热源,用冷水浴使反应物迅速冷却到室温后,减压过滤,滤饼洗涤三次.
④在150mL某容器中配制稀盐酸(30mL水加7mL浓盐酸),将上述粗产物转移进该容器,加热并用玻璃棒搅拌,使间硝基苯胺溶解,冷却到室温后减压过滤.
⑤冷却滤液,在搅拌下滴加过量浓氨水到pH=8,滤液中逐渐析出黄色的间硝基苯胺.
⑥冷却到室温后减压过滤,洗涤滤饼到中性,抽干,产物重结晶提纯,在红外灯下干燥,称重,得2.56g.
回答下列问题:
(1)滴液漏斗较普通分液漏斗的优点保持恒压,便于液体顺利留下;第④步中配制稀盐酸的容器名称为烧杯.
(2)间二硝基苯和间硝基苯胺都有毒,因此该实验应在通风橱内进行.
(3)在铁和盐酸作用制得初生态氢原子(还原性远强于碱金属多硫化物)也可以将硝基还原为氨基,却未被采用,其可能原因为铁和盐酸作用还原性强,不具有选择性.
(4)第④步用盐酸溶解粗产品,而不用水的原因间硝基苯胺微溶于水,但可与盐酸作用可以形成盐溶于水中.
(5)第③步中滤饼洗涤三次,可选用的洗涤剂为A;第⑥步产物要进行重结晶,可选用的试剂为B.
A.冷水 B.热水 C.乙醚 D.乙醇
(6)第③步中,搅拌使间二硝基苯与水形成悬浮液后再滴加多硫化钠溶液,其原因为增大接触面积,加快反应速率,提高原料利用率.
(7)第⑥步中要将滤饼洗涤到中性,检验方法为用玻璃棒蘸取最后一次洗涤液,滴在pH试纸中央,测定pH,若pH=7,说明已经洗涤到中性.
(8)该反应的产率为66.7%.