
根据碳、钙、铜等元素的单质及其化合物的结构和性质,请回答下列问题:
(1)实验室用CaC2与水反应生成乙炔:
①①将乙炔通入[Cu(NH3)2]Cl溶液中反应生成红棕色Cu2C2沉淀,Cu+基态核外电子排布式为__________。其在酸性溶液中不稳定,可发生歧化反应生成Cu2+和Cu,但CuO在高温下会分解成Cu20,试从结构角度解释高温下CuO何会生成Cu2O:__________。
②CaC2中C22-与O22+互为等电子体,0.5molO22+中含有的π键数目为__________;
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是__________,构成丙烯腈的元素中第一电离能最大的是__________。
(2)①铜元素的醋酸盐晶体局部结构如图甲,该晶体中含有的化学键是__________(填选项序号)
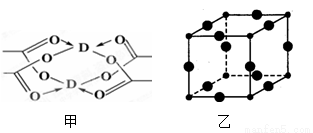
A.极性键 B.非极性键 C.配位键 D.金属键
②Cu3N的晶胞结构如图乙,N3-的配位数为__________ ,Cu+半径为acm,N3-半径为bcm,Cu3N的密度为__________ g•cm-3.(阿伏加德罗常数用NA表示)。
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源:2016届黑龙江哈尔滨六中高三下三模理综化学试卷(解析版) 题型:选择题
短周期主族元素W、X、Y和Z的原子序数依次增大。其中W的阴离子的核外电子数与X、Y、Z原子的核外内层电子数相同。X是形成化合物种类最多的元素,Y的最简单氢化物与Cl2混合后产生白烟,Z元素无正化合价。根据以上叙述,下列说法中正确的是
A.由W与X组成的化合物的沸点总高于由W与Y组成的化合物的沸点
B.以上四种元素的原子半径大小为W<X<Y<Z
C.W、X、Y、Z原子的核外最外层电子数的总和为23
D.W 与 Y 可形成离子化合物
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三临考模拟化学试卷(解析版) 题型:选择题
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl?、S2-
B.使酚酞变红的溶液中可能大量存在Na+、ClO?、SO42-、I?
C.碱性溶液中可能大量存在Na+、K+、HCO3?、CO32-
D.中性溶液中可能大量存在Fe3+、K+、SCN-、SO42-
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:选择题
铜片和锌片用导线连接后插入稀硫酸中,下列有关叙述正确的是( )
A.铜片为负极,其质量逐渐减少
B.锌片为负极,锌片上产生大量气泡
C.负极反应式为:Zn-2e-=Zn2+
D.正极反应式为:Cu-2e-=Cu2+
查看答案和解析>>
科目:高中化学 来源:2016届海南省高三考前预测化学试卷(解析版) 题型:选择题
下列转化关系中正确的是( )
A.SO2→SO3:2SO2+O2=2SO3
B.Fe→Fe2+:Fe+2H+=Fe2++H2↑
C.Cl-→Cl2:2Cl-+I2=Cl2+2I-
D.Cu→Cu(NO3)2:3Cu+8HNO3(浓)=Cu(NO3)2+NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三第八次月考理综化学试卷(解析版) 题型:选择题
芬顿( Fenton )试例,成分为双氧水和亚铁盐,需要酸性环境。电-Fenton法是用于水体里有机污染物降解的高级氧化技术。其反应原理如图2所示.其中电解产生的H2O2与Fe2+发生Fenton反应:Fe2++H2O2=Fe3++OH-+·OH,生成的羟基自由基(·OH)对有机物有极强的氧化能力。下列说法正确的是

A.a极是电源的正极
B.电解池中只有O2、Fe3+发生还原反应
C.阳极上发生电极反应:H2O-e-=·OH+H+
D.消耗1molO2,可以产生2mol·OH
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高三5月高考模拟理综化学试卷(解析版) 题型:推断题
芳香化合物A是一种基本化工原料,可以从煤和石油中得到。OPA是一种重要的有机化工中间体.A、B、C、D、E、F和OPA的转化关系如下所示:
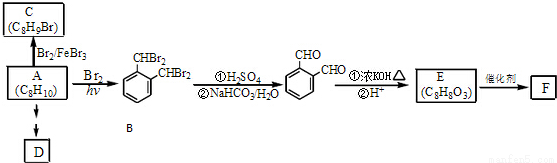
回答下列问题:
(1)A的化学名称是____________;
(2)由A生成B 的反应类型是____________,在该反应的副产物中,与B互为同分异构体的化合物的结构简式为____________;
(3)写出C所有可能的结构简式____________;
(4)D(邻苯二甲酸二乙酯)是一种增塑剂.请用A、不超过两个碳的有机物及合适的无机试剂为原料,经两步反应合成D。用结构简式表示合成路线____________;
(5)OPA的化学名称是____________,OPA经中间体E可合成一种聚酯类高分子化合物F,由E合成F的反应类型为____________,该反应的化学方程式为____________;(提示 )
)
(6)芳香化合物G是E的同分异构体,G分子中含有醛基、酯基和醚基三种含氧官能团,写出G所有可能的结构简式____________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高二5月月考化学试卷(解析版) 题型:实验题
化学实验是化学学科学习、探究的基础.
(1)下列描述错误的是___________
a.为了防止试剂瓶内的试剂被污染,取用后多余的试剂一定都不能放回原试剂瓶
b.滴定管、容量瓶、分液漏斗在使用时都需要检漏
c.海带中碘的提取时需要对干海带进行灼烧,此时需要用到的仪器有玻璃棒、燃烧匙、泥三角、三脚架、酒精灯
d.检验Na2SO3固体是否被氧化:取少量固体溶于水,加入Ba(NO3)2溶液,产生白色沉淀,滴加稀盐酸,观察白色沉淀是否溶解
e.海带中碘的提取时,对碘水中的碘进行萃取可采用裂化汽油、苯、四氯化碳、无水酒精等有机溶剂
(2)某溶液中可能存在Br-、CO32-、SO32-、I-、A13+、Mg2+、Na+等7种离子中的某几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,有白色沉淀生成,加入稀盐酸沉淀不溶解.
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色.据此可以推断:该溶液肯定存在的离子是:___________
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间。
实验 混合溶液 | A | B | C | D | E | F |
4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
①请完成此实验设计,其中:V1= ___________ ,V6= ___________ ,V9= ___________;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高,但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因:___________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年广东省汕头市高二下期末化学试卷(解析版) 题型:选择题
全氯乙烷(C2Cl6)可用作有机合成的原料。已知氯元素有两种稳定的同位素35Cl和37Cl,则C2Cl6的分子有( )种(不考虑立体异构)
A.8 B.9 C.10 D.11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com