
一定条件下可以大量共存的离子组是
A.Na+、Fe2+、NO3-、Cl- B.K+、HCO3-、SO42-、OH-
C.ClO-、Cl-、Na+、H+ D.Ba2+、K+、SO42-、H+
 巧学巧练系列答案
巧学巧练系列答案科目:高中化学 来源:2016届陕西省西安市高三上学期期中测试化学试卷(解析版) 题型:填空题
(12分)已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成对电子, B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。
(1)写出A元素的基态原子价电子排布式 ;F离子电子排布式 。
(2)写出X的化学式 和化学名称 。
(3)写出X涉及化工生产中的一个化学方程式 。
(4)试解释工业冶炼D不以DE3而是以D2A3为原料的原因: 。
(5)CE、FA的晶格能分别为786 KJ/mol l、3401KJ/mo,试分析导致两者晶格能差异的主要原因是: 。
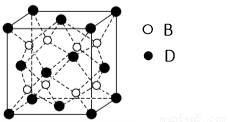
(6)F与B可形成离子化合物,其晶胞结构如图所示: F与B形成离子化合物的化学式为____________;该离子化合物晶体的密度为a g/cm3,则晶胞的体积是(只要求列出算式)。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省西安市高三上学期10月月考化学试卷(解析版) 题型:填空题
X、Y、Z、M、G五种元素分属三个短周期;且原子序数依次增大。X、Z同主族;可形成离子化合物ZX;Y、M同主族;可形成MY2、MY3两种分子。请回答下列问题:
(1)Y在元素周期表中的位置为 。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是 (写化学式);非金属气态氢化物还原性最强的是 (写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有 (写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH =-a kJ·mol-1;写出X2M燃烧反应的热化学方程式: 。
(5)ZX的电子式为 ;ZX与水反应放出气体的化学方程式为 。
(6)熔融状态下;Z的单质和FeG2能组成可充电电池(装置示意图如下);反应原理为2Z+FeG2 Fe+2ZG
Fe+2ZG

放电时;电池的正极反应式为 ;充电时; (写物质名称)电极接电源的负极:该电池的电解质为
查看答案和解析>>
科目:高中化学 来源:2016届广东省英德市高三上学期第二次月考理综化学试卷(解析版) 题型:选择题
下列实验操作或事实与预期实验目的或所得结论对应正确的是
A.淡黄色试液 红褐色沉淀 说明原溶液中一定含所有FeCl3
红褐色沉淀 说明原溶液中一定含所有FeCl3
B.H3PO3+2NaOH(足量)= Na2HPO3+2H2O H3PO3属于三元酸
C.新收集的酸雨 白色沉淀 酸雨中一定含有SO42﹣
白色沉淀 酸雨中一定含有SO42﹣
D.CaO  Ca(OH)2
Ca(OH)2  NaOH 用生石灰制备NaOH溶液
NaOH 用生石灰制备NaOH溶液
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上期中测试化学试卷(解析版) 题型:选择题
H2S溶液中,在采取措施使pH增大的同时,则c(S2﹣)的变化情况是
A.增大 B.减小
C.不变 D.可能增大,也可能减小
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期期中测试理综化学试卷(解析版) 题型:选择题
我们学习化学很重要的一个方面就是解决生活中的实际问题,下列家庭小实验不合理的是
A.用灼烧并闻气味的方法检验真皮衣料
B.用淀粉和水检验食盐中的碘元素
C.用食用碱(Na2CO3)溶液洗涤餐具上的油污
D.用食醋除去热水壶中的水垢
查看答案和解析>>
科目:高中化学 来源:2016届河北省保定市高三上学期摸底考试化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.向NH4Al(S04)2溶液中滴加过量Ba(OH)2溶液:
2Ba2++ 40H一+2S042-+ Al3+=2BaS04↓+2H20+ Al02一
B.向NaHS04溶液中滴人Ba(OH)2溶液至S042-完全沉淀:
2 H++S042-+Ba2++20H- =BaS04↓+2H20
C.向0. 1mol.L-l、pH=l的NaHA溶液中加入NaOH溶液:
HA-十OH-=A2-+H20
D.向1L lmol.L-1的FeBr2溶液中通人等物质的量Cl2:
2Cl2 +2Fe2++2Br—=4Cl-十2Fe3++ Br2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年湖北省高一上期中测试化学试卷(解析版) 题型:填空题
(共16分)
(1)在标准状况下,由CO2和SO2组成的混合气体8.96L,质量是23.6g。此混合物中CO2和SO2的物质的量比是 ① ,SO2的体积分数是 ② , S和O的原子个数比是 ③ 。
(2)现有200 ml Fe2(SO4)3的溶液中含Fe3+ 5.6g,则溶液中SO42-的物质的量浓度是 ④ 。
(3)在反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O中,得电子的物质是 ⑤ ,参加反应HNO3的和被还原的HNO3分子个数比为 ⑥ ,当生成的NO在标准状况下的体积为11.2L时,该反应转移的电子的物质的量为 ⑦ mol。
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期10月月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,则下列说法正确的是
A.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
B.向NH4Al(SO4)2稀溶液中逐滴加入过量Ba(OH)2溶液,离子方程式为:
NH4+ +Al3++2SO42-+ 2Ba2++ 5OH-=2BaSO4↓+ AlO2-+ 2H2O+NH3•H2O
C.常温下,由水电离出的H+浓度为10-13mol·L-1的溶液中,Fe2+、Cl-、Na+、NO3-可能大量共存
D.葡萄糖(C6H12O6)溶液中:SO42-、MnO4-、K+、H+ 可以大量共存
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com