
 +2H2O,其反应类型为酯化反应.
+2H2O,其反应类型为酯化反应.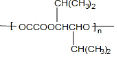 .
.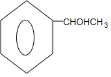 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$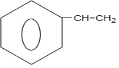 +H2O.
+H2O.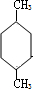 (填结构简式)
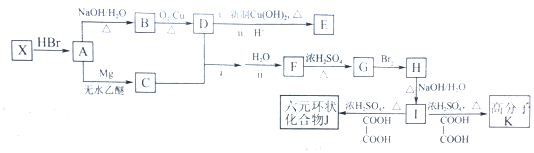
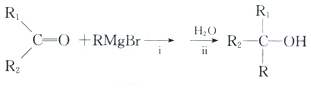
(填结构简式) 分析 烃X的相对分子质量为56,利用商余法确定其分子式为C4H8,核磁共振氢谱只有两个峰,且其与HBr加成后的氯代烃水解生成的醇氧化后的产物能够与新制氢氧化铜反应,说明X为(CH3)2C=CH2,A为(CH3)2CHCH2Br,A水解生成的B为(CH3)2CHCH2OH,B氧化生成的D为(CH3)2CHCHO,其与新制氢氧化铜反应生成的E为(CH3)2CHCOOH,据题给信息,(CH3)2CHCH2Br与Mg在无水乙醚作用下生成的C为(CH3)2CHCH2MgBr,据题给信息Ⅱ可知,(CH3)2CHCH2MgBr与(CH3)2CHCHO反应生成的F为(CH3)2CHCHOHCH2CH(CH3)2,F在浓硫酸作用下发生消去反应生成G,G的核磁共振氢谱有3个峰,且峰面积之比为12:2:2,可知G为(CH3)2CHCH=CHCH(CH3)2,G与Br发生加成反应生成的H为(CH3)2CHCHBrCHBrCH(CH3)2,H在NaOH溶液中水解生成的I为(CH3)2CHCHOHCHOHCH(CH3)2,I与乙二酸在浓硫酸作用下生成的六元环J为 ,I与乙二酸生成高分子化合物K为
,I与乙二酸生成高分子化合物K为 ,以此解答该题.
,以此解答该题.
解答 解:(1)X为(CH3)2C=CH2,名称为2-甲基丙烯,F为(CH3)2CHCHOHCH2CH(CH3)2,
故答案为:2-甲基丙烯;(CH3)2CHCHOHCH2CH(CH3)2;
(2)B为(CH3)2CHCH2OH,B氧化生成的D为(CH3)2CHCHO,醛基能够被新制氢氧化铜氧化为羧基,化学方程式为(CH3)2CHCHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2CHCOOH+Cu2O↓+2H2O,
故答案为:(CH3)2CHCHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2CHCOOH+Cu2O↓+2H2O;
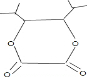
(3)I与乙二酸在浓硫酸作用下生成的六元环J为 ,化学方程式为(CH3)2CHCHOHCHOHCH(CH3)2+HOOCCOOH$→_{△}^{浓硫酸}$
,化学方程式为(CH3)2CHCHOHCHOHCH(CH3)2+HOOCCOOH$→_{△}^{浓硫酸}$ +2H2O,属于酯化反应,
+2H2O,属于酯化反应,
故答案为:(CH3)2CHCHOHCHOHCH(CH3)2+HOOCCOOH$→_{△}^{浓硫酸}$ +2H2O;酯化反应;
+2H2O;酯化反应;
(4)I为(CH3)2CHCHOHCHOHCH(CH3)2,I与乙二酸生成高分子化合物K为 ,
,
故答案为: ;
;
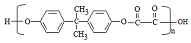
(5)以甲醛和苯甲醛为原料合成苯乙烯,首先将甲醛还原为甲醇,再与HBr反应生成CH3Br,CH3Br与Mg在无水乙醚作用下生成CH3MgBr,CH3MgBr与苯甲醛反应生成 ,其发生消去反应生成
,其发生消去反应生成 ,则最后一步的化学方程式为
,则最后一步的化学方程式为 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,故答案为:
+H2O,故答案为: $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(6)G为(CH3)2CHCH=CHCH(CH3)2,共有8个C原子,G的同分异构体中(不考虑立体异构),含有一个六元环,环外还有2个C原子,可以是乙基,有1种,可以是2个甲基,临间对有3种,共4种结构,核磁共振氢谱只有3组峰的是 ,
,
故答案为:4; .
.
点评 本题考查有机物的合成,为高频考点,侧重考查学生的分析能力,题目难度中等,注意把握有机物官能团的性质和变化,为解答该题的关键,易错点为(5),注意根据物质的性质设计反应流程.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
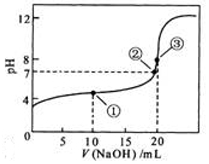 常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )
常温下,用 0.1000molL -1NaOH溶液滴定 20.00mL0.1000molL -1CH 3COOH溶液所得滴定曲线如图.下列说法正确的是( )| A. | 滴定过程中可能出现:c (CH 3COO -)>c (Na +)>c (CH 3COOH)>c (H +)>c (OH -) | |
| B. | 点①所示溶液中酸的中和率大于50% | |
| C. | 点②是二者恰好中和点 | |
| D. | 点③所示溶液中:c (Na +)>c (OH -)>c (CH 3COO -)>c (H +) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
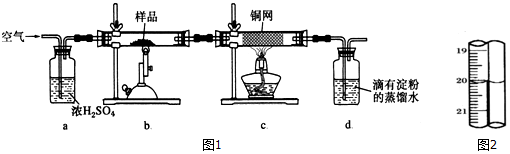
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
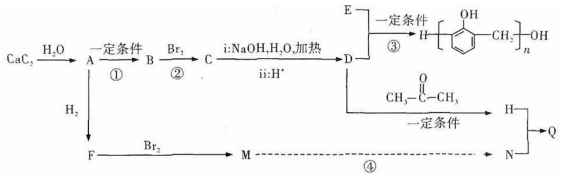
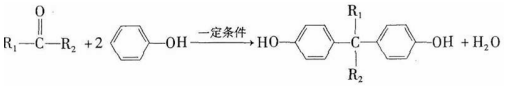
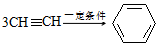 .
.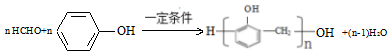 .
. .
. 或
或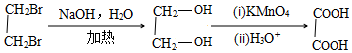 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | 平衡常数 | |
| C(s) | H2O(g) | H2(g) | |||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | t1 | K1 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | t2 | K2 |
| A. | T1<T2 | |
| B. | 乙容器中,当反应进行到$\frac{{t}_{2}}{2}$min时,n(H2O)=1.4 mol | |
| C. | K2=1.35 mol•L-1(或K2=1.35) | |
| D. | 混合气体的密度始终保持不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电离能大的元素,不易失电子,易得到电子,表现非金属性 | |
| B. | 电离能大的元素其电负性必然也大 | |
| C. | 电负性最大的非金属元素形成的含氧酸的酸性最强 | |
| D. | 电离能最小的元素形成的氧化物的水化物的碱性最强 |
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:填空题
目前工业合成氨的原理是:N2(g)+3H2(g) 2NH3(g) △H=-93.0kJ/mol
2NH3(g) △H=-93.0kJ/mol
(1)己知一定条件下:2N2(g)+6H2O(l) 4NH3(g)+3O2(g) △H=+1530.0kJ/mol。
4NH3(g)+3O2(g) △H=+1530.0kJ/mol。
则表示氢气燃烧热的热化学方程式为____________________。
(2)在恒温恒容装置中进行合成氨反应,各组分浓度-时间图像如下。
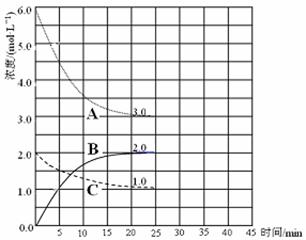
① 表示N2浓度变化的曲线是 (填序号)。
② 前25min 内,用H2浓度变化表示的化学反应速率是 。
③ 在25min时,采取下列措施,能使N2的转化率提高的是_________(填序号)。
a.通入1molN2 b. 通入1molH2 c. 通入1molHe气
d. 通入1molNH3 e. 通入1molHCl f. 通入1molN2和3molH2
(3)在恒温恒压装置中进行工业合成氨反应,下列说法错误的是_________(填序号)。
a.气体体积不再变化,则已平衡
b.气体密度不再变化,则已平衡
c.平衡后,压缩容器,会生成更多NH3
d.平衡后,往装置中通入一定量Ar,平衡不移动
(4)电厂烟气脱氮:主反应为:①4NH3(g)+6NO(g) 5N2(g)+6H2O(g) △H<0
5N2(g)+6H2O(g) △H<0
副反应为:②2NH3(g)+8NO(g) 5N2O(g)+3H2O(g) △H>0
5N2O(g)+3H2O(g) △H>0
平衡混合气中N2与N2O含量与温度的关系如右图所示。
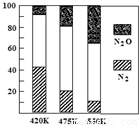
请回答:在400~600K时,平衡混合气中N2含量随温度的变化规律是__________,导致这种规律的原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com