
【题目】向20 mL HCl和H2SO4的混合溶液中逐滴加入0.1 mol·L-1的Ba(OH)2溶液,生成沉淀的质量和溶液的pH与加入的Ba(OH)2溶液体积的关系如图5所示。试完成下列问题:
 图5
图5
(1)起始时,混合酸中硫酸的物质的量浓度为______________ mol·L-1。
(2)起始时,混合酸中盐酸的物质的量浓度为______________ mol·L-1。
(3)B点表示的沉淀的质量为______________g。
(4)A点表示溶液中的c(H+)为______________ mol·L-1,pH为______________。
(5)C点的pH为______________(pH可直接用对数表示)。
【答案】0.10.40.4660.2071.18或-lg![]()
【解析】
向20 mL HCl和H2SO4的混合溶液中逐滴加入0.1 mol·L-1的Ba(OH)2溶液,加入20 mL 0.1 mol·L-1的Ba(OH)2溶液时沉淀量达到最大,说明与硫酸反应消耗20mL Ba(OH)2溶液;加入60 mL 0.1 mol·L-1的Ba(OH)2溶液时pH=7,说明与盐酸反应消耗Ba(OH)2溶液的体积是60-20=40mL。
(1)设混合酸中硫酸的物质的量浓度为xmol/L;
Ba(OH) 2 + H2SO4= BaSO4 + 2H2O
1 1
0.1mol/L![]() 0.02L xmol/L
0.02L xmol/L ![]() 0.02L
0.02L
![]()
X=0.1 mol·L-1。
(2)设混合酸中盐酸的物质的量浓度为ymol/L;
Ba(OH) 2 + 2HCl= BaCl2 + 2H2O
1 2
0.1mol/L![]() 0.04L ymol/L
0.04L ymol/L ![]() 0.02L
0.02L
![]()
y=0.4 mol·L-1。(3)B点表示的沉淀的物质的量,![]() 0.002mol,质量为0.002mol
0.002mol,质量为0.002mol![]() =0.466g;
=0.466g;
(4)A点表示溶液中硫酸恰好被完全中和,溶质是HCl,c(H+)=![]() ;pH=
;pH= ![]() ;(5)C点的溶液表示盐酸中的氢离子被中和了一半。C点溶液中c(H+)=
;(5)C点的溶液表示盐酸中的氢离子被中和了一半。C点溶液中c(H+)=![]() ;pH=
;pH= ![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】用3.0g乙酸和4.6g乙醇反应,若实际产率是理论产率的67%,则可得到的乙酸乙酯的质量为:
A. 2.95gB. 4.4gC. 7.48gD. 8.8g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家正在研究开发新的能源,如核能、太阳能、风能、地热、潮汐热等。“绿色能源”是目前正在研究的新能源之一,把高粱、玉米等绿色植物的种子经发酵、蒸馏就可以得到“绿色能源”中的一种。这种物质是
A.氢气 B.甲烷 C.酒精 D.木炭
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列设计的实验方案能达到相应实验目的的是
选项 | 实验目的 | 实验方案 |
A | 探究化学反应的限度 | 取5mL0.1mol/LKI溶液,滴加0.1molLFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
B | 探究浓度对化学反应速率的影响 | 用两支试管各取5ml.0.1mo/L的KMnO4溶液,分别加入2mL0.1mol/L和10.2mol/L的H2C2O4(草酸)溶液,记录溶液褪色所需的时间 |
C | 证明海带中含有碘元素 | 将海带剪碎、加蒸馏水浸泡,取滤液加几滴稀硫酸和1mLH2O2,再加入几滴淀粉溶液,溶液变蓝 |
D | 验证CH3COONa 溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体(其水溶液呈中性),观察溶液颜色变化 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乳酸亚铁晶体{[CH3CH(OH)COO]2Fe·3H2O}是一种很好的食品铁强化剂,易溶于水,吸收效果比无机铁好,可由乳酸与FeCO3反应制得:
2CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe·3H2O +CO2↑。
I.制备碳酸亚铁:装置如图所示。
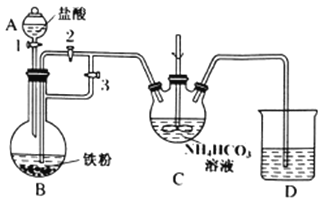
(1)C的名称是___________。
(2)清洗仪器,检查装置气密性,A中加入盐酸,B中加入铁粉,C中加入NH4HCO3溶液。为顺利达成实验目的,上述装置中活塞的打开和关闭顺序为:关闭活塞______,打开活塞______;加入足量盐酸后,关闭活塞1,反应一段时间后,关闭活塞____,打开活塞_____。C中发生的反应的离子方程式为_______________。
Ⅱ.制备乳酸亚铁晶体:
将制得的FeCO3加入乳酸溶液中,加入少量铁粉,在75℃下搅拌使之充分反应。然后再加入适量乳酸。
(3)加入少量铁粉的作用是______________。从所得溶液中获得乳酸亚铁晶体所需的实验操作是隔绝空气低温蒸发,________、干燥。
Ⅲ.乳酸亚铁晶体纯度的测量:
(4)若用KMnO4滴定法测定样品中Fe2+的量进而计算纯度时,发现结果总是大于100%,其原因可能是_____________________。
(5)经查阅文献后,改用Ce(SO4)2标准溶液滴定进行测定。反应中Ce4+离子的还原产物为Ce3+。测定时,先称取5.760g样品,溶解后进行必要处理,用容量瓶配制成250mL溶液,每次取25.00mL,用0.1000mol/LCe(SO4)2标准溶液滴定至终点,记录数据如下表。
滴定次数 | 0.1000mol/LCe(SO4)2标准溶液体积/mL | |
滴定前读数 | 滴定后读数 | |
1 | 0.10 | 19.85 |
2 | 0.12 | 21.32 |
3 | 1.05 | 20.70 |
则产品中乳酸亚铁晶体的纯度为_________(以质量分数表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
B. 甲烷的燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH= —890.3kJ·mol-1
C. 原电池中发生的反应达到平衡时,该电池仍有电流产生
D. 500 mL 2.0 mol·L-1的HCl(aq)和500 mL 2.0 mol·L-1的NaOH(aq)反应,产生的热量等于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像不符合反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
FeO(s)+H2(g) ΔH<0 的是(图中v是速率,φ为混合物中H2的体积百分含量)( )
A. 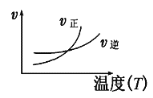 B.
B. 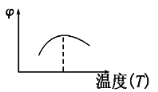
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于从碘水中萃取碘的实验,下列说法错误的是( )
A.分液漏斗使用前要检验其是否漏液
B.萃取剂要求不溶于水,且碘在其中的溶解度比在水中的大
C.注入碘水和萃取剂,倒转分液漏斗反复用力振荡后立即分液
D.该实验需要选用的仪器是烧杯、分液漏斗、铁架台(带铁圈)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

(1)用离子方程式表示Na2CrO4溶液中的转化反应____________。
(2)由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”),溶液中c(Cr2O72-)与c(CrO42-)的比值将_____________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为________________ (水的浓度不计入平衡常数表达式)。
(3)升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
(4)向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液的pH下降,生成的砖红色沉淀的化学式为_______________。
(5)+6价铬的化合物毒性较大,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+,反应的离子方程式为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com