
| A. | 用10mL量筒量取8.10mL稀盐酸 | |
| B. | 可用25mL酸式滴定管量取20.00mL KMnO4溶液 | |
| C. | 用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸 | |
| D. | 用pH计测得某溶液的pH为2 |
分析 A.量筒的感量为0.1mL;
B.酸式滴定管的感量为0.01mL;
C.pH试纸不能湿润;
D.pH计测定值准确到小数点后一位数.
解答 解:A.量筒的感量为0.1mL,则用10mL量筒量取8.1mL稀盐酸,故A错误;
B.酸式滴定管的感量为0.01mL,则用25mL酸式滴定管量取20.00mL KMnO4溶液,故B正确;
C.pH试纸不能湿润,选干燥的pH试纸测定溶液的pH,故C错误;
D.pH计测定值准确到小数点后一位数,不能为正整数,故D错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握仪器的使用、pH的测定、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:解答题
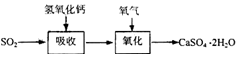
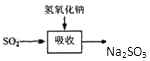
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
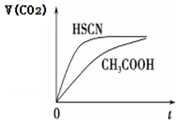 已知25℃时部分弱电解质的电离平衡常数数据如表:
已知25℃时部分弱电解质的电离平衡常数数据如表:| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.7×10-5 | 6.2×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 在密闭容器中发生反应:X+2Y?2Z(△H<0),其中Z显气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是( )
在密闭容器中发生反应:X+2Y?2Z(△H<0),其中Z显气态,且Z在平衡混合气中的体积分数(Z%)与温度(T)、压强(P)的关系如图,下列判断正确的是( )| A. | Y一定呈气态 | |
| B. | T1大于T2 | |
| C. | 升高温度,该反应的化学平衡常数增大 | |
| D. | 当c(X):c(Y):c(Z)=1:2:2时,反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2$→_{放电}^{O_{2}}$NO$\stackrel{H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓硫酸}$Cl2$\stackrel{石灰乳}{→}$漂白粉 | |
| C. | 黄铁矿$\stackrel{沸腾炉}{→}$SO3$→_{水}^{吸收塔}$硫酸 | |
| D. | CuSO4(aq) $\stackrel{NaOH溶液}{→}$Cu(OH)2$→_{△}^{蔗糖}$Cu2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量的NH3•H2O:Al3++4NH3•H2O═[Al(OH)4]-+4NH4+ | |
| B. | 检验用硫酸亚铁制得的硫酸铁中是否含有硫酸亚铁,可用KMnO4溶液 | |
| C. | 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,金属铝的熔点较低 | |
| D. | 将铜粉加1.0 mol•L-1Fe2(SO4)3溶液中,溶液变蓝,有黑色固体出现,说明金属铁比铜活泼 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com