
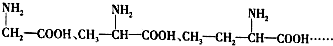
 ,B
,B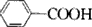 ,CCH2(NH2)COOH.
,CCH2(NH2)COOH. 分析 (1)通式为(CH2)n(NH2)COOH,利用数学求极限的方法计算,n无限大时,C元素的含量接近之间重复基团CH2中碳元素的质量分数;
(2)①先根据M=ρ×Vm求出相对分子质量,然后结合相对分子质量,根据质量守恒求出0.1molA各原子的个数,最后求出A的分子式;
②B物质仅由C、H、O三种元素组成,其物质的量之比为7:6:2,则分子式为C7H6O2,应为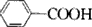 ,C的俗名为甘氨酸,为CH2(NH2)COOH,则A为
,C的俗名为甘氨酸,为CH2(NH2)COOH,则A为 ,以此解答该题.
,以此解答该题.
解答 解:(1)观察式子,符合通式(CH2)n(NH2)COOH,利用数学求极限的方法计算,n无限大时,C元素的含量接近之间重复基团CH2中碳元素的质量分数,C元素的质量分数最大值为$\frac{12}{14}$×100%=85.7%,
故答案为:85.7%;
(2)①M(A)=8.0g/L×22.4L/mol=179.2g/mol,则相对分子质量为179.2,
取17.92gA完全燃烧,生成的气体通过浓硫酸,浓硫酸增重8.10g,即水的质量为8.10g,物质的量为$\frac{8.10g}{18g/mol}$=0.45mol,
剩余气体通过碱石灰,气体质量减少39.60g,即二氧化碳的质量为39.60g,物质的量为$\frac{39.60g}{44g/mol}$=0.9mol,
另取17.92gA完全分解,可得标准状况下氮气1.12L,物质的量为$\frac{1.12L}{22.4L/mol}$=0.05mol,
所以0.1mol A可产生0.45mol H2O,0.9mol CO2和0.05mol N2,即1mol A 中含9mol C、9mol H、1mol N,
设A的分子式为C9H9NOX 则:9×12+9+14+16x=179.2,解得x=3,所以A的分子式是C9H9NO3,
答:A的分子式是C9H9NO3;
②B物质仅由C、H、O三种元素组成,其物质的量之比为7:6:2,则分子式为C7H6O2,应为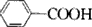 ,C的俗名为甘氨酸,为CH2(NH2)COOH,则A为
,C的俗名为甘氨酸,为CH2(NH2)COOH,则A为 ,
,
故答案为: ;
;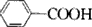 ;CH2(NH2)COOH.
;CH2(NH2)COOH.
点评 本题考查有机物的推断,侧重于学生的分析、计算能力的考查,题目着重于考查有机物分子式的确定,题目难度较大,注意掌握判断有机物分子式的方法,本题中计算相对分子质量为本题的解答关键.


科目:高中化学 来源: 题型:选择题
| A. | 离子半径:丁>丙>乙 | |
| B. | 电解法可以用乙与丙形成的化合物制得丙单质 | |
| C. | 同周期元素中丁的最高价氧化物对应水化物的酸性最强 | |
| D. | 81号元素铊与丙元素处同主族,则铊的最高价氧化物对应水化物呈两性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
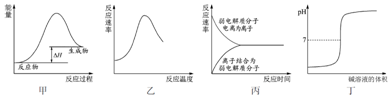
| A. | 图甲表示燃料燃烧反应的能量变化 | |
| B. | 图乙表示酶催化反应的反应速率随反应温度的变化 | |
| C. | 图丙表示弱电解质在水中建立电离平衡的过程 | |
| D. | 图丁表示强碱滴定强酸的滴定曲线 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
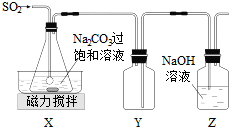
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无机含氧酸分子中的氧原子数越多,则其酸性也越强 | |
| B. | 氯化银能溶于过量的氨水.是因为它与氨水反应生成了一种可溶性的配位化合物 | |
| C. | 分子是否具有极性决定分子中是否存在极性共价键 | |
| D. | 氢键就是一种存在于某些特殊含氢元素的分子中的一种化学键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
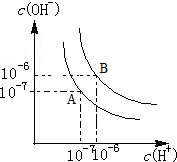 水的电离平衡如图所示.
水的电离平衡如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com