
| c4(H2O) |
| c4(H2) |
| c4(H2O) |
| c4(H2) |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
| A、W的最高价氧化物能与水反应生成相应的酸 |
| B、M原子核内比X多一个质子,M的气态氢化物的水溶液能溶解Z的氧化物 |
| C、U单质可以溶解于X和U形成的化合物中 |
| D、Y、Z、U元素的简单离子半径由大到小的顺序:Y>Z>U |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)甲醇是一种优质燃料,可制作燃料电池.
(1)甲醇是一种优质燃料,可制作燃料电池.| 化学键 | C-C | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ?mol-1 | 348 | 413 | 436 | 358 | 750 | 463 |
| 3 |
| 2 |
查看答案和解析>>
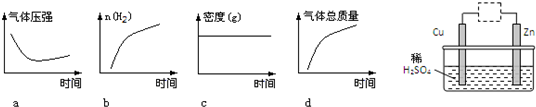
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com