
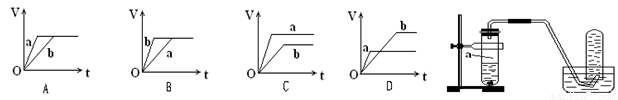
向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液。下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
科目:高中化学 来源:2013-2014山西省汾阳市高一期末统考化学试卷(解析版) 题型:填空题
(11分)乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答下列问题。
(1)乙烯的电子式____________,结构简式____________。
(2)鉴别甲烷和乙烯的试剂是______(填序号)。
A.稀硫酸B.溴的四氯化碳溶液 C.水D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是______(填序号)。
A.CH3CH3B.CH3CHCl2 C.CH3CH2OHD.CH3CH2Br
(4)已知 2CH3CHO+O2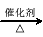 2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。
2CH3COOH。若以乙烯为主要原料合成乙酸,其合成路线如下图所示。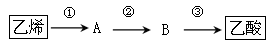
反应②的化学方程式为____________________________________。工业上以乙烯为原料可以生产一种重要的合成有机高分子化合物,其反应的化学方程式为_______________,反应类型是______________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省第二学期期末考试高一化学试卷(解析版) 题型:填空题
(14分)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如下图所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
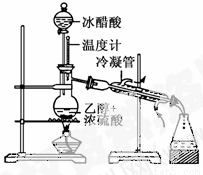
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是_________________________________。
(2)在烧瓶中加入一定比例的乙醇和浓硫酸的混合液的方法是:__________________________。
(3)在该实验中,若用1 mol乙醇和1 mol乙酸在浓硫酸作用下加热,充分反应,能否生成1mol乙酸乙酯?________,原因是__________________________________。
(4)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。请在图中圆括号内填入适当的试剂,在方括号内填入适当的分离方法。
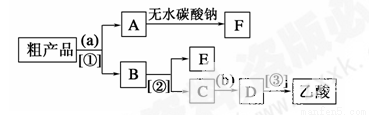
试剂a是__________,试剂b是__________;分离方法①是________,分离方法②是________,分离方法③是______。
(5)在得到的A中加入无水碳酸钠粉末,振荡,目的是________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省第二学期期末考试高一化学试卷(解析版) 题型:选择题
下列关于有机化合物的说法正确的是( )
A.乙酸和乙酸乙酯可用Na2CO3溶液加以区别 B.汽油、乙烯均为石油分馏产品
C.可以用分液的方法分离硝基苯和苯 D.有机化合物都能燃烧
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:填空题
(9分)A、B、C三种元素的原子具有相同的电子层数,而B的核电荷数比A大1,C原子的电子总数比B原子的电子总数多4; 1molA的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时A转变为与氖原子具有相同电子层结构的离子。试请回答:
(1)用电子式表示A和C组成的化合物的形成过程为______________________;
(2)B离子的电子式是 ,与B的离子具有相同电子数的分子中,有一种分子可与盐酸化合生成盐,该分子的电子式是 ;
(3)周期表中与C上下相邻的同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)写出B最高价氧化物的水化物和C最高价氧化物的水化物之间反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:选择题
键能是指破坏(或形成)1mol化学键所吸收(或放出)的能量。现查得:H-H、Cl-Cl和H-Cl的键能分别为436kJ/mol、243kJ/mol和431kJ/mol,请用此数据估计,由Cl2、H2生成1molHCl时的热效应为( )
A.放热91.5kJ B.放热183kJ C.吸热183kJ D.吸热91.5kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省高一下学期期中化学试卷(解析版) 题型:选择题
下列有关原子结构和元素周期律的表述正确的是 ( )
①原子序数为15的元素的最高化合价为+3 ②ⅦA族元素是同周期中非金属性最强的元素 ③第二周期ⅣA族元素的原子核电荷数和中子数一定为6 ④原子序数为12的元素位于元素周期表的第三周期ⅡA族
A.①② B.①③ C.②④ D.③④
查看答案和解析>>
科目:高中化学 来源:2013-2014山西省5月月考高二化学试卷(解析版) 题型:选择题
下列关于醇和酚的说法中,正确的是
A.含有羟基的化合物一定是醇
B.分子内有苯环和羟基的化合物一定是酚
C.羟基跟链烃基相连时,有机物为醇
D.酚和醇具有相同的官能团,因而具有相同的化学性质
查看答案和解析>>
科目:高中化学 来源:2013-2014山西忻州一中、长治二中、临汾一中、康杰中学高三化学(解析版) 题型:选择题
元素周期表有许多有趣的编排方式,有同学将短周期元素按照原子序数递增的顺序进行排列得到如图所示的“蜗牛”元素周期表。图中每个“·”代表一种元素(图中字母不表示元素符号)。下列说法正确的是
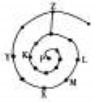
A.L、M、X三元素位于同一族
B.K、Z两元素的氢化物的水溶液都显酸性
C.Y元素对应的氢化物比K元素对应的氢化物沸点低
D.K、L、X、Z四种元素离子半径大小顺序是Z->L+>X3+>K3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com