
| A. | ①②③ | B. | ②③ | C. | ①③ | D. | ①② |
分析 1911年英国科学家卢瑟福用一束质量比电子大很多的带正电的高速运动的α粒子轰击金箔,结果是大多数α粒子能穿过金箔且不改变原来的前进方向,但也有一小部分改变了原来的方向,还有极少数的α粒子被反弹了回来,据此他提出了带核的原子结构模型.由于极少数α粒子发生了大角度偏转,原子有全部正电荷集中在原子中央很小的体积内,即原子核内.
解答 解:a粒子散射实验现象为:绝大多数α粒子穿过金箔后仍沿原来的方向前进,但有少数α粒子发生了较大的偏转,并有极少数α粒子的偏转超过90°,有的甚至几乎达到180°而被反弹回来.卢瑟福根据该实验现象提出了原子核式结构模型:原子的全部正电荷和几乎全部质量都集中在原子核里,带负电的电子在核外空间里绕着核旋转,卢瑟福提出了原子结构的行星模型,否定葡萄干面包原子模型,故A正确.
故选:A.
点评 本题考查卢瑟福的α粒子散射实验,了解卢瑟福核式结构模型提出的历史背景及其过程,知道α粒子散射实验现象及其结论是解答关键,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属钠非常活泼 | |
| B. | 钠可以从硫酸铜溶液中还原出铜单质 | |
| C. | 钠在氯气中燃烧产生大量的白烟 | |
| D. | 钠元素在自然界中都是以化合态存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 离子组 | X试剂 | 离子方程式 |
| A | Fe2+、Na+、SO42-、Cl- | 碘水 | 2Fe2++I2═2Fe3++2I- |
| B | pH=8的溶液中:Na+、HCO3-、Cl- | 少量澄清石灰水 | Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
| C | 透明溶液中:NH4+、Fe3+、Cl-、AlO2- | 过量铜粉 | Cu+2Fe═2Fe2++Cu2+ |
| D | K+、Na+、SO42-、ClO- | 少量SO2 | 2Cl-+SO2+H2O═2HClO+SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
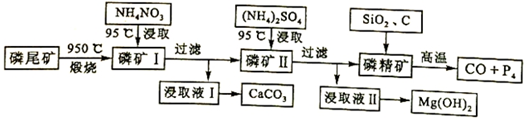
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
| H2 | SO2 | H2 | SO2 | ||
| 容器Ⅰ | 300 | 0.3 | 0.1 | / | 0.02 |
| 容器Ⅱ | 300 | 0.6 | 0.2 | / | / |
| 容器Ⅲ | 240 | 0.3 | 0.1 | / | 0.01 |
| A. | 该反应的正反应吸热 | |
| B. | 到达平衡时,容器Ⅰ中SO2的转化率比容器Ⅱ的大 | |
| C. | 240℃时,该反应的平衡常数为1.08×104 | |
| D. | 到达平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
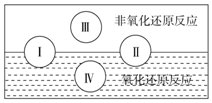 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.
氧化还原反应在生产、生活中具有广泛的用途,贯穿古今.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1:1 | B. | 1:2:3 | C. | 3:1:1 | D. | 6:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | X的简单阴离子与Y的简单阳离子半径:X<Y | |
| B. | X分别与Z、W、Q形成的最简单化合物的稳定性:Z<W<Q | |
| C. | ZQ3分子中的所有原子最外层均满足8电子结构 | |
| D. | W、Q形成的含氧酸均为强酸. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com