
【题目】下列物质溶解过程中化学键未被破坏的是( )
A.NaClB.HCl
C.CH3CH2OHD.SO2
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. K2FeO4可代替Cl2处理饮用水,有杀菌消毒作用
B. CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为1:2
C. 《本草纲目》中“以火烧之,紫青烟起,乃真硝石”利用焰色反应区分硝石(KNO3)和朴硝(Na2SO4)
D. 高温下可用金属钠还原四氯化钛来制取金属钛
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙基香草醛(3-乙氧基-4-羟基苯甲醛)是一种广泛使用的可食用香料。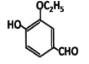 与乙基香草醛互为同分异构体,遇FeCl3溶液显紫色,且苯环上只有两个侧链的酯类的同分异构体种类有( )
与乙基香草醛互为同分异构体,遇FeCl3溶液显紫色,且苯环上只有两个侧链的酯类的同分异构体种类有( )
A. 6种 B. 15种 C. 18种 D. 21种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一。运用铁及其化合物有关知识,回答下列问题:
(1)铁和铁合金是生活中的常用材料,下列叙述中,正确的是(______)
A.铁在冷的浓硝酸中钝化 B.生铁耐腐蚀性强,不易生锈
C.不锈钢是铁合金,只含金属元素 D.铁在一定条件下,可与水蒸气反应
(2)向沸水中逐滴滴加1 mol·L-1FeCl3溶液,至液体呈透明的红褐色,该反应的离子方程式为________________________________
(3) 焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生反应的体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。
①写出并配平该反应的化学方程式:_________________________________
②发生氧化反应的物质是________,反应中4 mol的氧化剂能________(填“失去”或“得到”)________ mol电子。
③反应中产生了11.2 L(标准状况)的气体时,被还原的物质的质量为________。
(4)高铁酸钠Na2FeO4 是一种新型净水剂。
①高铁酸钠主要通过如下反应制取:
2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3X+5H2O,则X的化学式为___________。
②高铁酸钠在水中可以发生如下反应:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2。
4Fe(OH)3+8OH-+3O2。
由此看来,高铁酸钠能够杀菌消毒是因为它具有________性,而能够除去水中悬浮物是因为_______________________________________________________
③下列物质能作净水剂(能除去水中的悬浮物)的有____________。
A.KAl(SO4)2·12H2O B.[Fe(OH)(SO4)]n C.ClO2 D.“84”消毒液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、M、R五种元素中,原子序数依次增大,其结构或性质信息如下表。请根据信息回答有关问题:
元素 | 结构或性质信息 |
X | 原子的L层上s电子数等于p电子数 |
Y | 原子核外的L层有3个未成对电子 |
Z | 在元素周期表的各元素中电负性仅小于氟 |
M | 单质常温、常压下是气体,原子的M层上有1个未成对的p电子 |
R | 第四周期过渡元素,其价电子层各能级处于半充满状态 |
(1)元素M的原子核外有 ______ 种不同运动状态的电子;
(2)五种元素中第一电离能最高的是_______写元素符号;
(3)在Y形成的单质中,![]() 键与
键与![]() 键数目之比为______,在
键数目之比为______,在![]() 中Z原子的杂化方式为_____,其分子的空间构型为 ______;
中Z原子的杂化方式为_____,其分子的空间构型为 ______;
(4)R的一种配合物的化学式为![]() 。已知
。已知![]() 在水溶液中用过量硝酸银溶液处理,产生
在水溶液中用过量硝酸银溶液处理,产生![]() AgCl沉淀,此配合物最可能是 ______填序号。
AgCl沉淀,此配合物最可能是 ______填序号。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现对冶金硅进行电解精炼提纯可降低高纯硅制备成本。相关电解槽装置如图所示,用Cu-Si合金作硅源,在950℃利用三层液熔盐进行电解精炼,有关说法不正确的是
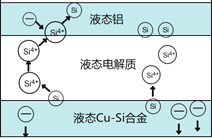
A. 在该液相熔体中Cu优先于Si被氧化,Si4+优先于Cu2+被还原
B. 电子由液态Cu-Si合金流出,从液态铝流入
C. 三层液熔盐的作用是增大电解反应面积,提高硅沉积效率
D. 电流强度不同,会影响硅提纯速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将 0.10 mol·L-1 盐酸滴入 20.00 mL 0.10 mol·L-1 氨水中,溶液中 pH 和 pOH 随加入盐酸体积变化曲线如图所示。已知:pOH=-lg c(OH-),下列正确的是

A. M 点所示溶液中可能存在c(Cl-)> c(NH4+)
B. N 点所示溶液中可能存在:c (NH4+)+ c(NH3﹒H2O)= c(Cl-)
C. Q 点盐酸与氨水恰好中和
D. M 点到Q点所示溶液中水的电离程度先变大后减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮可以形成多种离子和分子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)写出N2H62+中共价键的类型除极性键,非极性键外再写出一种__________。
(2)下列关于NH2-的说法合理的是____________________(填字母)。
A.H-N-H夹角109.5° B. H-N-H夹角180° C. H-N-H夹角大约105°
D.中心原子的杂化轨道为四面体形 E. 该离子为V形 F.易与H+结合
(3)写出N3-的等电子体且是中性分子的化学式___________________(一种)。
(4)N2H4名称是肼,也叫联氨,通常为无色油状发烟液体,有吸湿性,有氨的臭味。可作为火箭的燃料。其沸点比氨气高的主要原因是________________________。
利用含N的铜萃取剂M可通过如下反应实现铜离子的富集:
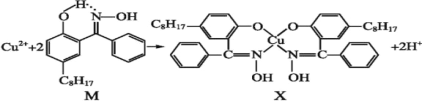
(5)X难溶于水、易溶于有机溶剂,X中配位原子是______。
(6)M中氮原子以_______杂化轨道与氧原子形成σ键。
(7)M与W(如图)是同分异构体,则在水中溶解度较大的物质是___(填字母M或W)。
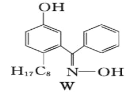
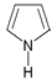
(8)常用![]() 表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为
表示分子中的大π键,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,例如苯分子中的大π键可表示为![]() 。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
。吡咯(如图)中的各个原子均在同一平面内且吡咯分子中也含有大π键,已知氮原子有一对未参与杂化的电子占据p轨道,吡咯分子中的大π键应表示为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com