
【题目】关于容量瓶的四种叙述:①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水.这些叙述中正确的是( )
A.①②③④
B.②③
C.①②④
D.②③④
科目:高中化学 来源: 题型:
【题目】工业上可由乙苯生产苯乙烯,反应原理如下:![]()
下列说法正确的是
A. 酸性高锰酸钾溶液和溴水都可以用来鉴别乙苯和苯乙烯
B. 乙苯、苯乙烯均能发生取代反应、加聚反应,氧化反应
C. 乙苯的一氯取代产物有共有5种
D. 乙苯和苯乙烯分子内共平面的碳原子数最多均为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素类药物中间体G(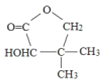 ),可按如下线路含成:
),可按如下线路含成:
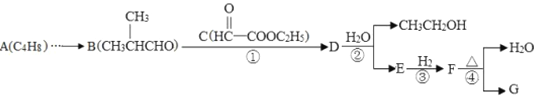
其中A~G分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知: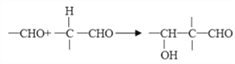
完成下列填空:
(1)A的名称是__________________,F的官能团_________________。
(2)写反应类型:反应①______________,②______________。
(3)G可以转化为化合物M(C6H10O),写出满足下列条件的2种M的结构简式:______、_______。
①分子中除羟基外还有一种碳碳不饱和键;②链状且不存在![]() 结构;
结构;
③分子中只有3种不同化学环境的氢原子。
(4)设计一条由A制备B的合成路线。_____________
(合成路线常用的表示方式为:![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是一种工业盐,外观与食盐非常相似,毒性较强。
Ⅰ.经查:①Ksp(AgNO2)=2×10-8,Ksp(AgCl)=1.8×10-10;②Ka(HNO2)=5.1×10-4。请设计最简单的方法鉴别NaNO2和NaCl两种固体______________________
Ⅱ. 某小组同学用如下装置(略去夹持仪器)制备亚硝酸钠
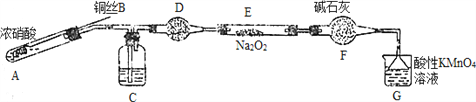
已知:①2NO+Na2O2=2NaNO2; ②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+。
(1)使用铜丝的优点是________________________。
(2)装置A中发生反应的化学方程式为_____________________________。
装置C中盛放的药品是_________;(填字母代号)
A.浓硫酸 B.NaOH溶液 C.水 D.四氯化碳
(3)该小组称取5.000g制取的样品溶于水配成250ml溶液,取25.00ml溶液于锥形瓶中,
用0.1000mol·L-1酸性KMnO4溶液进行滴定,实验所得数据如下表所示:
滴定次数 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
①第一次实验数据出现异常,造成这种异常的原因可能是_________(填字母代号)。
a.锥形瓶洗净后未干燥
b.酸式滴定管用蒸馏水洗净后未用标准液润洗
c.滴定终点时仰视读数
②酸性KMnO4溶液滴定亚硝酸钠溶液的离子方程式为___________________。
③该样品中亚硝酸钠的质量分数为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图是表示相应变化的能量关系图,其中正确的是( )
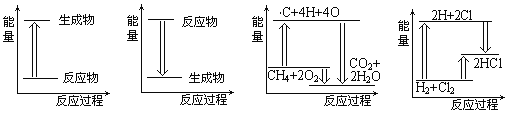
A. 锌与稀硫酸的反应 B. 植物的光合作用 C. 天然气燃烧 D. H2与Cl2反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,0.1molNa2CO3与盐酸混合所得的一组体积为1L的溶液,溶液中部分微粒与pH的关系如下图所示。下列有关溶液中离子浓度关系叙述正确的是
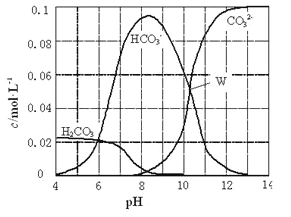
A. W点所示的溶液中:c (Na+)+c (H+)=2c(CO32-)+c (OH-)+c (Cl-)
B. pH=8的溶液中:c (H+)+c (H2CO3)+c (HCO3-)= c (OH-)+c (Cl-)
C. pH= 4的溶液中:c (H2CO3)+c (HCO3-)+c (CO32-)<0.1mol·L-1
D. pH=11的溶液中:c (Na+)>c (Cl-)>c (CO32-)>c (HCO3-)>c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里用浓盐酸与高锰酸钾反应来制取少量的氯气,反应的化学方程式为:2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O.反应物中,氧化剂是;化合价升高的元素是 . 反应中HCl的作用是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
A. 1:2 B. 1:4 C. 3:4 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E、F六种元素,它们的原子序数由A到F依次增大。在周期表中,A的原子半径最小。B元素的原子最外层电子数是内层电子数的两倍,C为地壳中含量最多的元素,D是原子半径最大的短周期主族元素,D单质燃烧时呈现黄色火焰,D的单质在高温下与C的单质充分反应,可以得到与E单质颜色相同的淡黄色固态化合物。D与F形成的离子化合物DF是常用的调味品。试根据以上叙述回答:
(1)元素名称:C________、D________、F________。
(2)E在元素周期表中的位置:______________________________。
(3)A、B组成的最简单化合物的结构式是_________________。
(4)C、D按原子个数比1∶1组成的一种化合物与A、E按原子个数比2∶1组成的一种化合物发生反应的化学方程式为_________________________。
(5)能说明E的非金属性比F的非金属性_______(填“强”或“弱”)的事实是:________(举一例)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com