
分析 I.由实验①溶液呈酸性,一定含H+,则不含CO32-;
由实验②加入少量CCl4及数滴新制氯水,经振荡后CCl4层呈紫红色,说明溶液中一定含有I-,而I-与Fe3+、NO3-和H+能发生氧化还原反应,而不能共存,说明溶液中肯定不含有Fe3+、NO3-;
由实验③加入NaOH溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀,可知不含Mg2+、Al3+;
由实验④另取部分上述碱性溶液加Na2CO3溶液,有白色沉淀生成,沉淀为碳酸钡,可知一定含有Ba2+,不含CO32-、SO42-;
由⑤将实验③中的碱性溶液加热,有气体放出,该气体能使湿红色石蕊试纸变蓝,可知气体为氨气,原溶液中一定含NH4+,不能确定是否含K+、Cl-;
II.KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中,只有Cu2O具有还原性,与硝酸发生14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O,反应中Cu元素化合价由+1价升高到+2价,N元素化合价由+5价降低到+2价,以此来解答.
解答 解:Ⅰ.(1)由上述分析可知,一定含I-、Ba2+、NH4+,一定不含Mg2+、Al3+、Fe3+、SO42-、CO32-、NO3-,
故答案为:I-、Ba2+、NH4+;
(2)上述实验不能确定是否含K+、Cl-,
故答案为:K+、Cl-;
Ⅱ.(1)要使硝酸根离子发生还原反应,则需要加入还原剂,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中KMnO4、Fe2(SO4)3具有强氧化性,Na2CO3没有氧化性和还原性,Cu2O有还原性,所以能使硝酸根离子发生还原反应的是Cu2O,二者反应生成硝酸铜、NO和水,反应方程式为14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O,
故答案为:14HNO3+3Cu2O=6Cu(NO3)2+2NO↑+7H2O;
(2)生成硝酸铜体现酸性,生成NO体现硝酸的强氧化性,故答案为:酸性、氧化性;
(3)反应中若产生0.2mol气体,则转移电子的数为0.2mol×(5-2)×NA/mol=0.6 NA或3.612×1023,
故答案为:0.6 NA或3.612×1023;
(4)若1mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是使用了较浓的硝酸,产物中有部分二氧化氮生成,
故答案为:使用了较浓的硝酸,产物中有部分二氧化氮生成.
点评 本题考查离子推断及氧化还原反应,为高频考点,把握离子之间的反应、物质的性质、实验技能为解答的关键,侧重分析与推断、实验能力的考查,综合性较强,题目难度不大.


 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
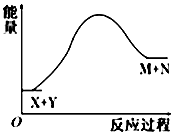
| A. | X的能量一定低于M的能量,Y的能量一定低于N的能量 | |
| B. | 因为该反应为吸热反应,故一定要加热反应才能进行 | |
| C. | 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量 | |
| D. | X和Y的总能量一定低于M和N的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 ;
; ,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键).
,该物质属于离子(离子、共价)化合物,该物质溶于水会破坏离子键(离子键、共价键). ,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.
,该物质属于共价(离子、共价)化合物,该物质在受热气化时化学键没有(有、没有)遭到破坏.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
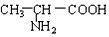 与
与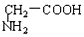
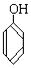 和
和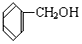
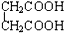 和
和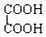
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属Mg和金属Cu的空间利用率 | |
| B. | BF3和CH4中心原子的价层电子对数 | |
| C. | 邻羟基苯甲醛(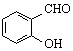 )和对羟基苯甲醛( )和对羟基苯甲醛(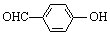 )的沸点 )的沸点 | |
| D. | C-O和Si-O的键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | F、Cl、Br、I最高正化合价都为+7 | |
| B. | 卤族元素的单质只有氧化性 | |
| C. | 从F到I,原子的得电子能力依次加强 | |
| D. | 卤素单质与H2化合的难易程度按F2、Cl2、Br2、I2的顺序由易变难 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com