
| A. | 过渡元素 | B. | 稀有气体 | C. | 主族元素 | D. | 卤族元素 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第三周期所含元素中氯的第一电离能最大 | |
| B. | 磷的电负性比硫的电负性大 | |
| C. | 自然界所有元素中,氦的第一电离能最大,铯的第一电离能最小 | |
| D. | 第四周期中元素砷的第一电离能比元素硒的第一电离能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极为Fe,负极为Zn,电解质Fe2(SO4)3溶液 | |
| B. | 正极为Cu,负极为Fe,电解质FeCl3溶液 | |
| C. | 正极为Cu,负极为Fe,电解质Fe(NO3)3溶液 | |
| D. | 正极为Ag,负极为Fe,电解质Fe2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
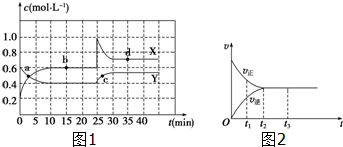
| 时间(s) 物质的量(mol) 物质 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
| SO2 | 1 | 0.7 | 0.5 | 0.35 | 0.2 | 0.01 | 0.1 | 0.1 |
| O2 | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
| SO3 | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
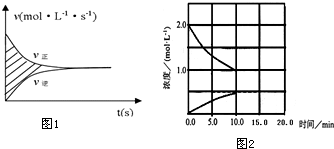
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 提高反应物的利用率 | B. | 改变平衡混合物的组成 | ||
| C. | 以同样程度改变正逆反应的速率 | D. | 增大正反应速率,减小逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
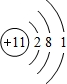 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com