


科目:高中化学 来源: 题型:
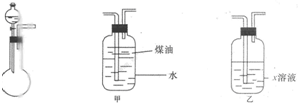 (2010?大连二模)有一化学样品Na2SO3,可能含有NaCl、Na2SO4、KNO3、K2CO2、K2SO4中的一种或几种杂质,某实验小组利用图提供的装置确定该样品的成分及Na2SO3的质量分数.称此样品6.30g,加入6.0mol?L-1的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色.请回答下列问题:
(2010?大连二模)有一化学样品Na2SO3,可能含有NaCl、Na2SO4、KNO3、K2CO2、K2SO4中的一种或几种杂质,某实验小组利用图提供的装置确定该样品的成分及Na2SO3的质量分数.称此样品6.30g,加入6.0mol?L-1的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
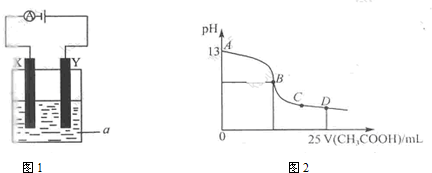
查看答案和解析>>
科目:高中化学 来源: 题型:
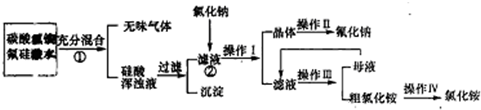
查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com