
【题目】下列各组物质中,按单质、化合物、混合物的顺序排序正确的是
A. 稀有气体、尿素、冰与水混合 B. 白磷、浓硫酸、胆矾
C. 金刚石、漂白粉、大理石 D. 水银、干冰、盐酸
科目:高中化学 来源: 题型:
【题目】(1)根据反应8NH3+3Cl2![]() 6NH4Cl+N2,回答下列问题:
6NH4Cl+N2,回答下列问题:
①该反应中氧化剂是 ,氧化产物是 。
②该反应中被氧化的物质与被还原的物质物质的量之比为 。
(2)某一反应体系中存在下列6种物质:NO、FeSO4、Fe(NO3)3、HNO3、Fe2(SO4)3和H2O。已知存在下列转化关系:HNO3→NO,请完成下列各题:
①该反应的氧化剂是 ,还原剂是 。
②该反应中1 mol氧化剂 (填“得到”或“失去”) mol电子。
③当有0.1 mol HNO3被还原,此时生成标准状况下NO的体积是 L。
④请把各物质填在下面空格处,需配平:
______+□______![]() □______+□______+□______+□
□______+□______+□______+□
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A.铁和稀硫酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
B.氯化铝溶液中加入过量氨水制取氢氧化铝:Al3++3NH3·H2O![]() Al(OH)3↓+3
Al(OH)3↓+3![]()
C.用FeCl3溶液腐蚀印刷电路板:Fe3++Cu![]() Fe2++Cu2+
Fe2++Cu2+
D.氢氧化钠溶液中通入少量二氧化硫气体 :SO2+OH![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将11.2L氢气在氯气中完全燃烧,放出92.4KJ热量,则该反应的热化学方程式是( )
A.H2(g)+Cl2(g)═ ![]() HCl(g)△H=+92.4KJ/mol
HCl(g)△H=+92.4KJ/mol
B.H2(g)+Cl2(g)═ ![]() HCl(g)△H=﹣92.4KJ/mol
HCl(g)△H=﹣92.4KJ/mol
C.H2(g)+Cl2(g)═2HCl(g)△H=﹣184.8KJ/mol
D.H2(g)+Cl2(g)═2HCl(l)△H=+184.8 KJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学称取一定质量的MgCl2固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如下图乙所示。

请回答下列问题:
(1)溶解MgCl2固体所用的玻璃仪器有______(填字母)。
a.天平 b.烧杯
c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________。
(3)AB段反应的离子方程式为______________________________________。
(4)在B点对应的溶液中滴加AgNO3溶液,观察到的现象是________,反应的离子方程式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化过程中,△S<0的是( )
A.NH3(g)与HCl(g)反应生成NH4Cl(s)
B.氯化钠溶于水中
C.CaCO3(S)分解为CaO(S)和CO2(g)
D.干冰(CO2)的升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员以传统中药为原料先制得化合物I,再转化为具有抗癌抑菌活性的化合物Ⅱ,有关转化如图所示,下列有关说法不正确的是( ) 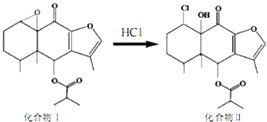
A.化合物I分子式为C19H24O5
B.化合物I 和Ⅱ均能与酸性KMnO4溶液和NaOH溶液反应
C.化合物Ⅱ一定条件下能发生取代、消去及加成反应
D.检验化合物Ⅱ中是否含化合物I可用Br2的CCl4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫醉钠又名“大苏打”,溶液具有弱碱性和较强的还原性,是棉织物漂白后的脱氯剂,定量分析中的还原剂.硫代硫酸钠(Na2S203)可由亚硫酸钠和硫粉通过化合反应制得,装置如图I所示.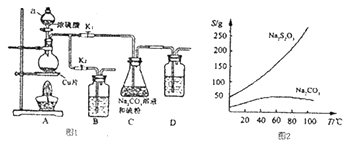
已知:Na2S2O3在酸性溶液中不能稳定存在,有关物质的溶解度曲线如图2所示.
(1)Na2S2O35H2O的制备:
步骤1:如图连接好装置后(未装药品),检查A、C装且气密性的操作是_ .
步骤2:加人药品,打开K1、关闭K2、加热.装置B、D中的药品可选用下列物质中的(填编号).
A.NaOH溶液 B.浓H2SO4C.酸性KMnO4溶液 D.饱和NaHCO3溶液
步骤3:C中混合液被气流搅动,反应一段时间后,硫粉的最逐渐减少.
步骤4:过滤C中的混合液,将滤液经过加热浓缩,趁热过滤,再将滤液过滤、洗涤、烘干,得到产品.
(2)Na2S2O3性质的检验:向足量的新制氯水中滴加少量Na2S2O3溶液,氯水颜色变浅,检查反应后溶液中含有硫酸根,写出该反应的化学方程式 .
(3)常用Na2S2O3溶液测定废水中Ba2+浓度,步骤如下:取废水25.00mL,控制适当的酸度加人足量K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解.此时Cr42﹣全部转化为Cr2O72﹣;再加过量KI溶液,充分反应后,加入淀粉溶液作指示剂,用0.010molL﹣1的Na2S2O3溶液进行滴定,反应完全时,消耗Na2S2O3溶液18.00mL.部分反应的离子方程式为:Cr2O72﹣+6I﹣+14H+═2Cr3++3I2+7H2O.I2+2S2O32﹣═S4O62﹣+2I﹣ , 则该废水中Ba2+的物质的量浓度为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com