
| A. | 用盐酸除铁锈 Fe2O3+6H+=2Fe3++3H2O | |
| B. | 将Na放入水中 2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 氢氧化铝溶于盐酸 OH-+H+=H2O | |
| D. | 小苏打与氢氧化钠反应 HCO3-+H+=CO2↑+H2O |
分析 A.反应生成氯化铁和水;
B.反应生成氢氧化钠和氢气;
C.氢氧化铝在离子反应中应保留化学式;
D.反应生成水和二氧化碳.
解答 解:A.用盐酸除铁锈,反应生成氯化铁和水,其离子方程式为:Fe2O3+6H+=2Fe3++3H2O,故A正确;
B.将Na放入水中,钠与水反应生成NaOH和氢气,其反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,故B正确;
C.氢氧化铝在离子反应中应保留化学式氢氧化铝溶于盐酸的离子反应为:Al(OH)3+3H+═3H2O+Al3+,故C错误;
D.小苏打与氢氧化钠反应 反应生成水和二氧化碳,其反应的离子方程式为:HCO3-+H+=CO2↑+H2O,故D正确;
故选C
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答的关键,注意离子反应中保留化学式的物质,题目难度不大.


 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案 期末好成绩系列答案
期末好成绩系列答案科目:高中化学 来源: 题型:选择题
| A. | 最外层有1个电子的原子 | B. | 最外层电子排布为ns2的原子 | ||
| C. | 最外层有3个未成对电子的原子 | D. | 次外层无未成对电子的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
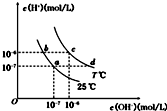
| A. | a点对应的溶液中大量存在:Fe3+、Na+、Cl-、SO42- | |
| B. | b点对应的溶液中大量存在:ClO-、Ba2+、OH-、I- | |
| C. | c点对应的溶液中大量存在:Na+、Ba2+、Cl- HCO3- | |
| D. | d点对应的溶液中大量存在:Na+、K+、SO32-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
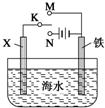 对金属制品进行抗腐蚀处理,可延长其使用寿命.
对金属制品进行抗腐蚀处理,可延长其使用寿命.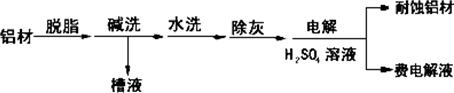
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
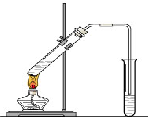 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题: CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9.0 | B. | 0.9 | C. | 0.45 | D. | 4.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com