
N2(g)+3H2(g) 2NH3(g) ��H����92.4 kJ��mol-1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ������˵���������
2NH3(g) ��H����92.4 kJ��mol-1������ʱ����ϵ�и�����Ũ����ʱ��仯��������ͼʾ������˵���������
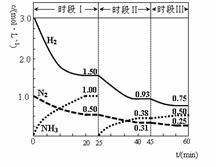
A��ǰ20���ӷ�Ӧ�ڷų�������Ϊ46.2kJ
B����25���Ӹı�������ǽ�NH3�ӷ�Ӧ��ϵ�з����ȥ
C������60����ʱ��Ӧ�ִﵽ��ƽ�⣬��ʱ��ı�������ǽ����¶�
D��ʱ�������ʼͶ�ŵ�����Ũ������ԭ����2������Ӧ���ת��������ƽ�ⳣ������
 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
���ǵ����Ϻ����ḻ��һ��Ԫ�أ������仯������������������������Ҫ���á�
��1����ͼ��1mol NO2�����1mol CO��Ӧ����CO2��NO�����������仯ʾ��ͼ����д��NO2�����CO��Ӧ���Ȼ�ѧ����ʽ�� ��

��2���ڹ̶�������ܱ������У��������»�ѧ��Ӧ�� N2(g)+3H2(g)![]() 2NH3(g)��
2NH3(g)��
�����и�����˵���÷�Ӧһ���ﵽƽ��״̬���� ������ĸ��
a��������N2��H2��NH3��Ũ��֮��Ϊ1��3��2 b��v(H2)(��) =)3v(N2)(��)
c��������ѹǿ���ֲ��� d�����������ܶȱ��ֲ���
����������Ӧ�ﵽƽ��ʱ��N2��H2��NH3��Ũ��֮��Ϊ1:3:2�����������а����ʵ���֮��Ϊ1:3:2ͨ��N2��H2��NH3����ԭƽ����ȣ�N2�����ʵ���Ũ�� ������������С����ͬ����NH3��������� ��
��3����ѧ��һֱ�����о����¡���ѹ�¡��˹��̵������·�������ش��������⣺
Ŀǰ��ҵ�ϳɰ���ԭ���ǣ�N2��g����3H2��g��![]() 2NH3��g������H<0��
2NH3��g������H<0��
����ͼ��ʾ�������ı䣬ƽ���������а����İٷֺ�
���ı仯���ơ���������Ϊѹǿʱ���仯������ȷ���ǣ�ѡ����ĸ��ţ���ͬ��_____________����������Ϊ�¶�ʱ���仯������ȷ����_________________��

��Һ����ˮ���ƣ����������ĵ��룬д��Һ����������ķ���ʽ�� ___________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
һ�������·�ӦN2(g)+3H2(g) 2NH3(g )��10L���ܱ������н��У����2min�ڣ�N2�����ʵ�����20mol��С��8mol����2min��NH3�ķ�Ӧ����Ϊ
A��1.2mol��(L��min) B��1mol��(L��min)
C��0.6mol��(L��min) D��0.4mol��(L��min)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011-2012ѧ�긣��ʡȪ����У�����ڶ���������ѧ�Ծ� ���ͣ�ѡ����
�ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����壬���ܱ������еķ�Ӧ��
N2(g)+3H2(g) 2NH3(g) ����H�� 0 �� 400�桢30MPa��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ����������������ǣ�
��
2NH3(g) ����H�� 0 �� 400�桢30MPa��n(NH3)��n(H2)��ʱ��仯�Ĺ�ϵ��ͼ����������������ǣ�
��

A����a������Ӧ���ʱ�b��Ĵ�
B����c����Ӧ��δ�ﵽƽ��
C����d��t1ʱ�̣��͵�e��t2ʱ�̣���n(N2)��һ��
D�������������䣬500���·�Ӧ��t1ʱ�̣� n(H2)����ͼ��d���ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�츣��ʡ�߶���ѧ�����п��Ի�ѧ�Ծ� ���ͣ�ѡ����
��ѧ��ӦN2+3H2=2NH3�������仯��ͼ��ʾ��E����ֵ���÷�Ӧ���Ȼ�ѧ����ʽ��
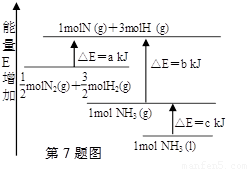
A��N2(g)+3H2(g)=2NH3(1)�� ��H=2(a-b-c)kJ��mol-1
B�� N2(g)+3H2(g)=2NH3(g)�� ��H=2(b-a)kJ��mol-1
C��1/2N2(g)+3/2H2(g)=NH3(1)�� ��H=(b+c-a)kJ��mol-1
D��1/2N2(g)+3/2H2(g)=NH3(g)�� ��H=(a+b)kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013�����ʦ���и߶�12�½μ�⻯ѧ�Ծ� ���ͣ�ѡ����
���жԻ�ѧƽ���ƶ��ķ����У�����ȷ����
���Ѵ�ƽ��ķ�ӦC(s)+H2O(g) CO(g)+H2(g)�������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ����
CO(g)+H2(g)�������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ����
����Ӧ�����ƶ�
���Ѵ�ƽ��ķ�ӦN2(g)+3H2(g) 2NH3(g)��������N2��Ũ��ʱ��ƽ��������Ӧ�����ƶ���N2��ת����һ������
2NH3(g)��������N2��Ũ��ʱ��ƽ��������Ӧ�����ƶ���N2��ת����һ������
��������μӵķ�Ӧ��ƽ��ʱ������С��Ӧ���ݻ���ƽ���������������ķ����ƶ�
��������μӵķ�Ӧ��ƽ��ʱ���ں�ѹ��Ӧ���г���ϡ�����壬ƽ��һ�����ƶ�
A���٢ڢ� B���٢ڢ� C���ڢۢ� D���٢ڢۢ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com