
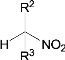
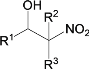
【题目】有两种有机物A![]() 与B(
与B(![]() ),下列有关它们的说法中正确的是( )
),下列有关它们的说法中正确的是( )
A.一定条件下,二者在NaOH溶液中均可发生取代反应
B.二者在NaOH醇溶液中均可发生消去反应
C.二者的核磁共振氢谱中均只出现两种峰且峰面积之比为3∶2
D.A的一氯代物只有1种、B的一溴代物有2种
科目:高中化学 来源: 题型:
【题目】实验室合成溴苯的装置图及有关数据如下,按下列合成步骤回答:
苯 | 溴 | 溴苯 | |
密度/g·cm-3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |

(1)实验装置中,仪器c的名称为__________________,作用为__________。
(2)在a中加入15 mL无水苯和少量铁屑,在b中小心加入4.0 mL液态溴,向a中滴入几滴溴,有白雾产生,是因为生成了________气体,继续滴加至液溴滴完。写出a中发生反应的化学方程式:__________________。
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用10 mL水、8 mL 10%的NaOH溶液、10 mL水洗涤。NaOH溶液洗涤的作用__________;
③向分出的粗溴苯中加入少量的无水氯化钙(一种干燥剂),静置、过滤。加入无水氯化钙的目的是__________________。
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为______,要进一步提纯,需进行的操作方法为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于化学反应方向说法正确的是 ( )
A.反应2A(g)+B(g) = 3C (s)+D(g)在一定条件下能自发进行,说明该反应的ΔH>0
B.常温下反应2Na2SO3(s)+O2(g)= 2Na2SO4(s)能自发进行,则ΔH<0
C.反应2Mg(s)+CO2(g)![]() C(s)+2MgO(s)能自发进行,则该反应的△H>0
C(s)+2MgO(s)能自发进行,则该反应的△H>0
D.一定温度下,反应2NaCl(s)=2Na(s)+Cl2(g)的 △H<0 ,△S>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
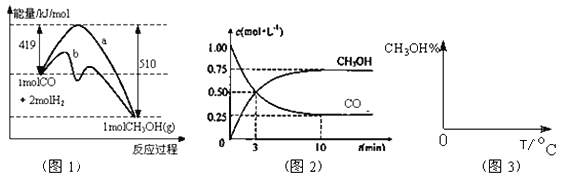
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建立平衡, v(H2)=_____;该温度下CO(g)+2H2(g)![]() CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为______。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数____ (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】去甲肾上腺素是一种重要的神经递质,以石油裂解产物A和邻甲氧基苯酚为原料,经过中间体藜芦醛,合成去甲肾上腺素的路线如下所示。
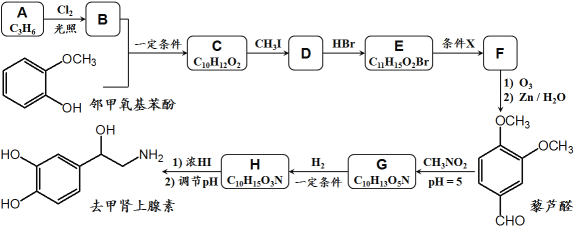
已知:①
![]()
![]()

②![]()
![]()
![]() +
+![]()
③![]() +
+
![]()
④D和F互为同分异构体。
回答下列问题:
(1)C → D的反应类型为__________,G → H的反应类型为__________;
(2)条件X为__________,E在条件X作用下发生变化的官能团名称为__________;
(3)关于上述合成,下列说法正确的是__________;(填序号)
a.1mol邻甲氧基苯酚能与3mol Br2发生取代反应
b.合成路线中CH3I和浓HI的作用是保护酚羟基不被O3氧化
c.藜芦醛分子中至少有14个原子共平面
d.1mol去甲肾上腺素熔化后至多可消耗3mol Na和2mol NaOH
(4)B + 邻甲氧基苯酚 → C的化学方程式为_______________________________;
(5)藜芦醛的同系物Y相对分子质量比藜芦醛大14,写出Y满足下列条件所有同分异构体的结构简式:
①能发生银镜反应;②1mol该有机物能消耗2mol NaOH(aq);③核磁共振氢谱有4组峰
__________________________________________________________;
(6)试设计以间苯二酚(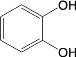 )为原料,制备聚酯
)为原料,制备聚酯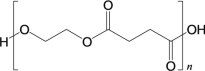 的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
的合成路线。(无机试剂任选,仅可使用间苯二酚作有机原料)___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组探究KI 与Cu(NO3)2 的反应,进行实验一:

注: 本实验忽略Cu2+在此条件下的水解。
(1)取棕黄色清液,加入少量______溶液(试剂a),清液变为______色,说明生成了I2。
(2)探究生成I2的原因。
①甲同学进行如下实验: 向2mL Imol/LKI 溶液中加入1mL______溶液( 硝酸酸化,pH=1.5 ),再加入少量试剂a,观察到与(1)相同的现象。甲同学由此得出结论: 实验一中生成I2 的原因是酸性条件下,NO3- 氧化了I-。
②乙同学认为仅由甲同学的实验还不能得出相应结论。他的理由是该实验没有排除____氧化I-的可能性。
③若要确证实验一中是NO3-氧化了I-,应在实验一的基础上进行检验______的实验。
(3)探究棕黑色沉淀的组成。
①查阅资料得知: CuI 为难溶于水的白色固体。于是对棕黑色沉淀的组成提出两种假设:
a.CuI吸附I2; b.______吸附I2。
为证明上述假设是否成立,取棕黑色沉淀进行实验二:

已知: CuI难溶于CCl4;I2+2S2O32-=2I-+S4O62-(无色);Cu++2S2O32-=Cu(S2O3)23-(无色)。
由实验二得出结论: 棕黑色沉淀是CuI吸附I2 形成的。
②现象ⅲ为______________。
③用化学平衡移动原理解释产生现象ii 的原因:________________。
④由实验二可推知,Cu(NO3)2 与KI 反应过程中,一定发生的反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸异戊酯常用于食用香精配方中,可调配香蕉、苹果、草莓等多种果香型香精。实验室制备乙酸异戊酯的反应为CH3COOH+(CH3)2CHCH2CH2OH![]() CH3COOCH2CH2CH(CH3)2+H2O,实验装置如图所示。
CH3COOCH2CH2CH(CH3)2+H2O,实验装置如图所示。
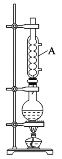
实验步骤如下:①在100 mL圆底烧瓶中加入一定体积的异戊醇和冰乙酸,摇匀后小心加入4 滴浓硫酸,投入1~2粒沸石。如图装置隔石棉网用酒精灯加热,回流反应30 min。
②待反应物冷却至室温,将其转移到100 mL分液漏斗中,依次用蒸馏水荡洗圆底烧瓶两次,荡洗液全部转入分液漏斗中,静置分层分离,弃水层,有机层加入NaHCO3溶液不断振荡,静置分层,分去水层。
③分出水层后的有机层转入干燥的锥形瓶中,加入约0.10 g无水硫酸镁,加盖静置10 min。然后液体转入100 mL圆底烧瓶中,加两粒沸石,装上直形冷凝管、接液管,常压下蒸馏,收集140~143℃馏分得产物。
(1)步骤①中加入沸石的目的是______,仪器A的名称是______。
(2)步骤②中,水洗的主要目的是______,NaHCO3洗涤完成的标志是______。
(3)步骤③中加入少量无水MgSO4的目的是______。
(4)用测相对分子质量的方法可检验所得产物是否纯净,测相对分子质量通常采用的仪器是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种化合物(如图)由W、X、Y、Z四种短周期元素组成,其中W、Y、Z分别位于三个不同周期,Y核外最外层电子数是W核外最外层电子数的二倍; W、X、Y三种简单离子的核外电子排布相同。下列说法不正确的是:
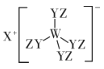
A.原子半径:W<X<Y<Z
B.简单离子的氧化性:W> X
C.X与Y、Y与Z均可形成具有漂白性的化合物
D.W与X的最高价氧化物的水化物可相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在已经发现的一百多种元素中,除稀有气体外,非金属元素只有十多种,但与生产生活有密切的联系。
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:
N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
①合成氨的反应中的能量变化如图所示。

该反应是___________反应(填“吸热”或“放热”),其原因是反应物化学键断裂吸收的总能量_____(填“大于”或“小于”)生成物化学键形成放出的总能量。
②在一定条件下,将一定量的N2和H2的混合气体充入某定容密闭容器中,一段时间后,下列叙述不能说明该反应达到平衡状态的是___________(填序号)。
A.容器中混合气体的密度不随时间变化
B.单位时间内断裂3 mol H-H键的同时断裂6 mol N-H键
C. N2 、H2 、NH3的物质的量之比为1:3:2
D.容器中混合气体的平均相对分子质量不随时间变化
(2)容器容积为1L,T2℃在起始体系中加入1 mol N2 、3molH2,经过5 min反应达到平衡时放55.44kJ。保持容器体积和温度不变,若起始时向容器内放入2 mol N2和6 mol H2,达平衡后放出的热量为Q,则Q___110.88 kJ(填“>”、“<”或“=”)。
(3)目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
CH3OH(g)+H2O(g),在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。
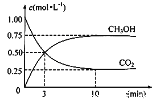
达平衡时容器内平衡时与起始时的压强之比___。
(4)有可逆反应Fe(s)+CO2(g) ![]() FeO(s) + CO(g) △H>0。
FeO(s) + CO(g) △H>0。
①若起始时把Fe和CO2放入体积固定的密闭容器中,CO2的起始浓度为2.0mol/L,某温度时达到平衡,此时容器中CO的浓度为1.0 mol/L,则该温度下上述反应的平衡常数K=______________(保留二位有效数字)。
②若该反应在体积固定的密闭容器中进行,在一定条件下达到平衡状态,如果改变下列条件,反应混合气体中CO2的物质的量分数如何变化(选填“增大”、“减小”、“不变”)。升高温度________________;再通入CO_________________。
③该反应的逆反应速率随时间变化的关系如图:
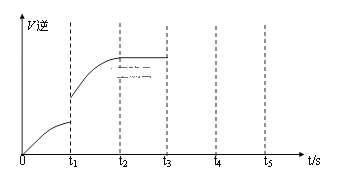
从图中看到,反应在t2时达平衡, 在t1时改变了某种条件,改变的条件可能是(填序号)______________。(单选)
A.升温 B.增大CO2浓度
④如果在t3时从混合物中分离出部分CO,t4~ t5时间段反应处于新平衡状态,请在图上画出t3~ t5的V(逆)变化曲线____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com