
(1)若盐酸足量,等物质的量的Na、Mg、Al产生的氢气质量之比为____________。
(2)若盐酸足量,等质量的Na、Mg、Al产生H2的质量之比为___________,溶液增重质量之比为_______________________。
(3)若盐酸等质量且足量,充分反应后所得溶液质量相等,则Na、Mg、Al质量之比为______________________________。
(4)若盐酸浓度相等,体积相等,投入的Na、Mg、Al质量相等,反应后有一种金属剩余,该金属是_________________________。
(5)称取Na、Mg、Al各m g,在室温下分别与V L 4 mol·L-1的盐酸充分反应,试推断,在下列三种情况下,V的取值范围(用含m的表达式表示)。
①Al与盐酸反应放出H2最多时,________________________。
②Na与盐酸反应放出H2最多时,________________________。
③Mg和Al与盐酸反应产生H2一样多时,_________________。
(1)1∶2∶3
(2)![]() ∶
∶![]() ∶
∶![]()
![]() ∶
∶![]() ∶
∶![]()
(3)![]() ∶
∶![]() ∶
∶![]()
(4)Al
(5)①V>![]() L ②V<
L ②V<![]() L ③V≤
L ③V≤![]() L
L
解析:(1)盐酸足量,有下列关系:
2Na+2HCl==2NaCl+H2↑
1 mol ![]() mol
mol
Mg+2HCl==MgCl2+H2↑
1 mol 1 mol
2Al+6HCl2==AlCl3+3H2↑
1 mol ![]() mol
mol
所以等物质的量的Na、Mg、Al产生氢气质量之比为![]() ∶1∶
∶1∶![]() =1∶2∶3。
=1∶2∶3。
(2)2Na+2HCl==2NaCl+H2↑ Δm
![]() mol
mol ![]() ·
·![]() mol
mol ![]()
Mg+2HCl==MgCl2+H2↑ Δm
![]() mol
mol ![]() mol
mol ![]()
2Al+6HCl==2AlCl3+3H2↑ Δm
![]() mol
mol ![]() ·
·![]() mol
mol ![]()
所以Na、Mg、Al产生氢气质量之比为
![]() ·
·![]() mol∶
mol∶![]() mol∶
mol∶![]() ·
·![]() mol=
mol=![]() ∶
∶![]() ∶
∶![]() 。
。
溶液增加的质量比为:![]() ∶
∶![]() ∶
∶![]()
(3)依题意知溶液增加质量相同。设加入Na、Mg、Al的质量分别为x、y、z。
2Na+2HCl==2NaCl+H2↑
2 mol 1 mol
![]() mol
mol ![]() ·
·![]() mol
mol
Mg+2HCl==MgCl2+H2↑
1 mol 1 mol
![]() mol
mol ![]() mol
mol
2Al+6HCl==2AlCl3+3H2↑
2 mol 3 mol
![]() mol
mol ![]() ·
·![]() mol
mol
即Na与盐酸反应后溶液增重:x-![]() ·
·![]() ·2=
·2=![]() g
g
Mg与盐酸反应后溶液增重:y-![]() ·2=
·2=![]() g
g
Al与盐酸反应后溶液增重:z-![]() ·
·![]() ·2=
·2=![]() g
g
即有:![]() =
=![]() =
=![]()
x∶y∶z=![]() ∶
∶![]() ∶
∶![]()
(4)由2Na+2HCl==2NaCl+H2↑
Mg+2HCl==MgCl2+H2↑
2Al+6HCl==2AlCl3+3H2↑
知等质量的Na、Mg、Al,Al消耗HCl最多,所以当只有一种金属剩余时,只能是Al。
(5)求Na、Mg、Al m g消耗HCl的体积(4 mol·L-1)。
2Na+2HCl==2NaCl+H2↑
![]() mol
mol ![]() mol
mol
V(HCl)=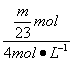 =
=![]() L
L
Mg+2HCl==MgCl2+H2↑
![]() mol
mol ![]() ·2 mol
·2 mol
V(HCl)= =
=![]() L
L
2Al+6HCl==2AlCl3+3H2↑
![]() mol
mol ![]() ·3 mol
·3 mol
V(HCl)= =
=![]() L
L
①保证等m的Na、Mg、Al与盐酸反应,Al产生的H2最多,即Na、Mg完全反应,HCl仍有剩余,即V(HCl)>![]() L。
L。
②保证等m的Na、Mg、Al与盐酸反应,Na产生H2最多,即Na过量,HCl不足,过量Na与水反应,而Mg、Al不与水反应,即V(HCl)<![]() L。
L。
③等质量的Na、Mg、Al与盐酸反应,Mg、Al产生H2一样多,即Mg、Al与盐酸反应时,HCl都不足或Mg恰好反应完全,过量Na与水反应,而Mg、Al不与水反应,即V(HCl)≤![]() L。
L。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A.1∶2∶3 B.23∶24∶37 C.23∶12∶9 D.36∶69∶92
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列各反应现象所归纳的元素性质不正确的是 ( )
A.将一小块钠投入到盛有硫酸铜溶液的烧杯中,发现没有紫红色的铜析出。不能说明钠的金属性比铜弱
B.用湿润的淀粉碘化钾试纸放置在有氯气产生的导管上端,发现试纸变蓝。说明氯元素的非金属性比碘元素强
C.把H2S气体和Cl2在集气瓶中混合,一段时间后发现瓶壁有淡黄色固体析出。说明Cl的非金属性比S强
D.将0.1 mol Na、Mg、Al分别与足量稀盐酸反应,除共同产生H2外,还分别生成了NaCl、MgCl2、AlCl3,金属失去的电子数分别为0.1 mol、0.2 mol、0.3 mol。说明这三种金属的活泼性为:Al>Mg>Na
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com