
根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 将1mL乙酸乙酯分别加入6mL同浓度的NaOH溶液和稀H2SO4中,水浴加热相同时间后,碱溶液中酯层完全消失,而酸中有 | 说明酯在NaOH溶液中的水解程度大于 H2SO4溶液中 |
B | 向10mL0.2mol·L?1NaOH溶液中滴入2滴0.1 mol·L?1MgCl2溶液,产生白色沉淀后,再滴加2滴0.1 mol·L?1FeCl3溶液,生成红褐色沉淀 | Ksp[Mg(OH)2]>Ksp[Fe(OH)3] |
C | 室温下,实验测得:0.1mol·L-1Na2CO3溶液的pH约为11.6;0.1mol·L-1 NaHCO3溶液的pH约为9.7 | CO32 |
D | 用3mL稀盐酸分别与等质量的Zn粒、Zn粉反应,Zn粉产生气体的速率快 | Zn粉的活泼性大于Zn粒 |
 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源:2017届西藏林芝一中高三上学期月考一化学试卷(解析版) 题型:选择题
香叶醇是合成玫瑰香油的主要原料,其结构简式如下:
下列有关香叶醇的叙述正确的是( )
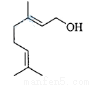
A.香叶醇的分子式为C10H18O B.不能使溴的四氯化碳溶液褪色
C.不能使酸性高锰酸钾溶液褪色 D.能发生加成反应不能发生取代反应
查看答案和解析>>
科目:高中化学 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:填空题
从含铜废料(如:覆铜板、印刷线路板及铅冰铜等)中提取铜,既可提高资源的利用率又可减少重金属污染。
(1)废覆铜板(Cu和Sn组成)可用CuSO4和H2SO4混合溶液作电解质溶液,直接电解回收精铜,阳极上发生的电极反应为 。
(2)废印刷线路板中的铜常用含盐酸的FeCl3溶液或H2O2-HCl- NaCl混合溶液浸取回收。
①用FeCl3溶液浸取铜时发生反应的离子方程式为 ;若加盐酸不足,反应一段时间后线路板表面有红褐色沉淀,产生红褐色沉淀的原因是 。
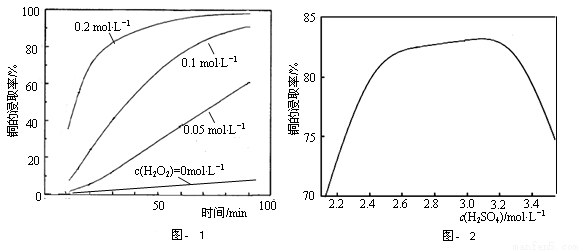
②将粉碎后的废印刷线路板放入三口烧瓶中,分别加入由0.3mol·L-1盐酸、0.5mol·L-1NaCl及不同浓度的H2O2组成的混合溶液,在温度、搅拌速率及固液比等均相同时,铜的浸取率随H2O2的浓度和时间的变化如图-1所示。当c(H2O2)= 0 mol·L-1时,也有少量的铜被浸出,其原因是 。
③用H2O2-HCl- NaCl混合溶液浸取时,其浸取过程包括:
(Ⅰ)Cu+H2O2+2H+=Cu2++2H2O
(Ⅱ)Cu2++Cu 2Cu+
2Cu+
(Ⅲ)Cu++nCl- CuCln(n-1)-
CuCln(n-1)-
(Ⅳ)2CuCln(n-1)-+2H++H2O2=2Cu2++2H2O+2nCl-
其他条件相同时,增大下列离子浓度可以加速Cu从废电路板中浸出的是 (填序号)。
a.Na+ b.Cu2+ c.Cl- d.OH-
(3)铅冰铜(PbS、Cu2S及FeS的混合物)可用HCl-H2O2混合溶液浸取。
①Cu2S被HCl-H2O2混合溶液浸取得到硫酸铜和氯化铜溶液的化学方程式为 。
②若由H2SO4代替HCl-H2O2中的HCl,其他条件相同,铜的浸取率随硫酸浓度的变化如图-2所示。当H2SO4浓度大于3.1mol·L-1时,硫酸浓度越大,铜的浸取率反而越小,其原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省盐城市高三上学期期中化学试卷(解析版) 题型:选择题
纤维素等生物碳源材料可以高产率制备石墨烯(如图),下列说法正确的是
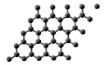
A.石墨烯导电属于化学变化
B.石墨烯与金刚石结构相同
C.纤维素与淀粉互为同分异构体
D.纤维素属于天然高分子化合物
查看答案和解析>>
科目:高中化学 来源:2017届江苏省徐州、宿迁、连云港、淮安四市高三11月模拟化学卷(解析版) 题型:填空题
FeCl3可用作印刷电路铜板腐蚀剂和外伤止血剂等
(1)若要溶解电路板上3.2g的铜,则至少需要1 mol·L-1 FeCl3溶液的体积为 mL。
(2)检验腐蚀电路铜板后的溶液中是否存在Fe3+的试剂是 。
(3)腐蚀电路铜板后的溶液中铜元素含量的测定:
取20.00mL腐蚀电路铜板后的溶液于碘量瓶中,先加足量NaF(发生的反应为Fe3++6F-=[FeF6]3-),再加足量的10%KI溶液,摇匀。塞上碘量瓶瓶塞,置于暗处5min,充分反应后(有CuI沉淀生成),加几滴淀粉溶液,用0.1000 mol·L?1Na2S2O3标准溶液滴定到终点时,共消耗20.00mL标准液。测定过程中有关物质的转化关系如下:
若测定过程中碘量瓶敞口置于暗处5min,会导致测定结果 (填:“偏高”、“偏低”、“无影响”)。
计算该腐蚀液中铜元素的含量(用g·L?1表示),写出计算过程。
查看答案和解析>>
科目:高中化学 来源:2017届江苏省徐州、宿迁、连云港、淮安四市高三11月模拟化学卷(解析版) 题型:选择题
下列说法正确的是( )
A.镀铜铁制品镀层破损后,铁制品比破损前更容易生锈
B.标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移电子数为2mol
C.水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
D.Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源:安徽省六安市2017届高三上学期第三次月考化学试卷(解析版) 题型:实验题
二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。工业上用潮湿的KClO3和草酸 (H2C2O4)在60℃时反应制得,某学生拟用下图所示的装置模拟制取并收集ClO2。
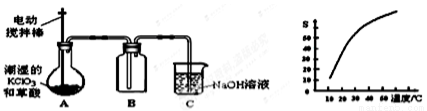
(1)B必须放在冰水浴中控制温度,其原因是_______________。
(2)反应后在装置C中可得NaClO2溶液.已知NaClO2饱和溶液中在温度低于38℃时析出晶体是NaClO2•3H2O,在温度高于38℃时析出晶体是NaClO2 。根据右上图所示的NaClO2溶解度曲线,请补充从NaClO2溶液中制NaClO2操作步骤:a______;b_______;③洗涤;④干燥。
(3)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
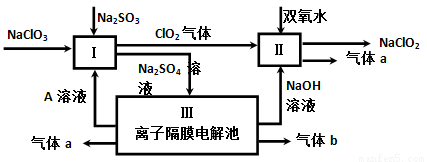
①I、III中发生反应的还原剂分别是_____、_____(填化学式)。
②Ⅱ中反应的离子方程式是___________。
③ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该反应化学方程式______。
④NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+物质的量_______。(填“相同”,“不同”或“无法判断”)
查看答案和解析>>
科目:高中化学 来源:安徽省六安市2017届高三上学期第三次月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数的值,下列说法中正确的是
A.常温常压下7.8gNa2S固体和7.8 gNa2O2固体中含有的阴离子数目均为0.1NA
B.标准状况下,2.24L Cl2和HCl的混合气体中含有的分子总数为2×6.02×1023
C.含1mol FeCl3的饱和溶液滴入沸水中得到胶体数目为NA
D.标准状况下,Na2O2与足量的CO2反应生成2.24LO2,转移电子数为0.4 NA
查看答案和解析>>
科目:高中化学 来源:2017届陕西西安市高三上第二次质量检测化学试卷(解析版) 题型:选择题
下列关于电解质溶液的叙述不正确的是
A.pH=11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈紫色
B.在pH=3的溶液中,Na+、Cl-、Fe2+、ClO-不能大量共存
C.常温下,pH=7的NH4Cl与氨水的混合溶 液中:c(Clˉ)=c(NH4
液中:c(Clˉ)=c(NH4 +)>c(H+)=c(OHˉ)
+)>c(H+)=c(OHˉ)
D.向0.1mol·L-1的氨水中加入少量硫酸铵固体,则溶液中c(OH-)/c(NH3·H2O)减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com