

| 自动脱水 |


| 醇 |
| 浓H2SO4/△④ |

| 催化剂 |
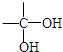
 ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 ;A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
;A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,据此解答.
,据此解答. ,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为
,结合碳原子碳原子连接2个羟基不稳定,自动转化为羰基,可推知B为 ,则G为
,则G为 .A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为
.A在氢氧化钠醇溶液、加热条件下发生消去反应得到C,C酸化得到D,A分子中有2个甲基,结合D的分子式可知,A为(CH3)2CBrCOOH,则C为CH2=C(CH3)COONa,D为CH2=C(CH3)COOH,综上分析可知X为 ,
, ,A、B中都含有的含氧官能团是羧基,故答案为:水解(或取代);消去;羧基;
,A、B中都含有的含氧官能团是羧基,故答案为:水解(或取代);消去;羧基; ,故答案为:AgBr;
,故答案为:AgBr; ;
;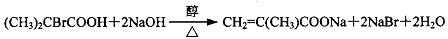 ,故答案为:
,故答案为: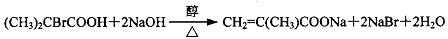 ;
; ,故答案为:
,故答案为: ;
; ,H的同分异构体符合下列条件:
,H的同分异构体符合下列条件: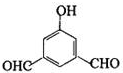 、
、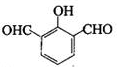 、
、 ,故答案为:
,故答案为: 、
、 、
、 等中的任意一种.
等中的任意一种.


科目:高中化学 来源: 题型:
| (1)草 酸晶体 | 分子式 | H2C2O4?2H2O | 颜色 | 无色晶体 | ||
| 熔点 | 100.1℃ | 受热至100.1℃时失去结晶水,成为无水草酸. | ||||
| (2)无 水草酸 | 结构简式 | HOOC-COOH | 溶解性 | 能溶于水或乙醇 | ||
| 特性 | 大约在157℃升华(175℃以上发生分解). | |||||
| 化学性质 | H2C2O4+Ba(OH)2=BaC2O4↓+2H2O | |||||
HOOC-COOH
| ||||||

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 蛇纹石可用于生产氢氧化镁,简要工艺流程如下:
蛇纹石可用于生产氢氧化镁,简要工艺流程如下:| Fe3+ | Al3+ | Fe2- | Mg2+ | |
| 开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
| 沉淀完全时 | 3.7 | 5.2 | 9.7 | 12.4 |
| 平行测定数据 | 平均值 | ||||
| 实验编号 | 1 | 2 | 3 | 4 | |
| 消耗H2O2溶液的体积/mL | 0.32 | 0.30 | 0.30 | 0.32 | 0.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 足量溶液A |
| 充分反应 |
| 足量溶液B |
| 充分反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
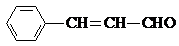 ,则关于该有机物的说法正确的是( )
,则关于该有机物的说法正确的是( )| A、1 mol该有机物发生银镜反应能生成 1 mol Ag |
| B、1 mol该有机物最多能够与6 mol H2 发生加成反应 |
C、它与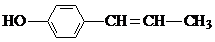 互为同分异构体 互为同分异构体 |
| D、该有机物能被酸性高锰酸钾溶液氧化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com