
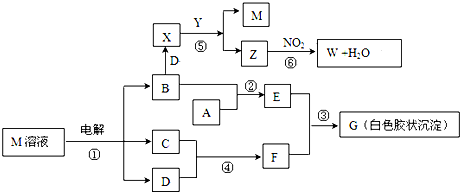
| ||
| ||
| 4 |
| 3 |
| 4 |
| 3 |


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
| A、宏观物体对外不显电性,是因为它们的组成微粒都是电中性的原子或分子 |
| B、利用化学方法,我们可以制造出新的分子,但不能制造出新的原子 |
| C、“低碳经济”就是要提倡大量使用煤、石油、天然气等化石燃料 |
| D、“绿色化学”的核心是利用化学原理对环境污染进行治理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 将浓硫酸滴到蔗糖表面 | 固体变黑膨胀 | 浓硫酸有脱水性和强氧化性 |
| B | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸不反应 |
| C | 二氧化硫通入品红溶液中 | 品红溶液褪色 | 二氧化硫具有还原性 |
| D | 将水蒸气通过灼热的铁粉 | 粉末变红 | 铁与水在高温下发生反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
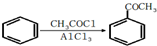 ,请结合题中所给信息,写出由CH3CH2COOH、为原料合成
,请结合题中所给信息,写出由CH3CH2COOH、为原料合成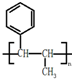 的合成路线流程图(无机试剂任选).合成路线流程图示例:H2C=CH2
的合成路线流程图(无机试剂任选).合成路线流程图示例:H2C=CH2| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1mol/L |
| B、0.2mol/L |
| C、0.4mol/L |
| D、0.8mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
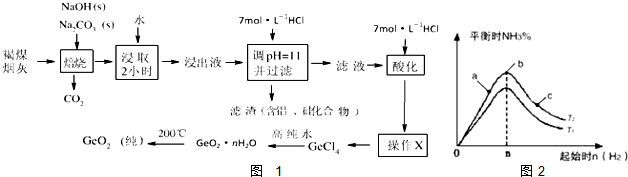
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2、Na2CO3 |
| B、Na2CO3 |
| C、Na2CO3、NaOH |
| D、Na2O2、Na2CO3、NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com