
分析 (1)设硼的有两种同位素10B和11B的物质的量分别为x、y,根据m=nM计算;
(2)根据元素的相对平均原子质量为该元素各同位素与占总量的百分比的乘积之和计算.
解答 解:(1)设硼的有两种同位素10B和11B的物质的量分别为x、y,100g硼中
10x+11y=100g,10x=18.5g,解得:x=1.85,y≈7.41,
答:100g硼中10B和11B的物质的量分别为:1.85、7.41;
(2)100g硼中,10B占18.5g,该同位素占总量的百分比为18.5%,则11B占总量的百分比为81.5%,硼的平均相对原子质量=10×18.5%+11×81.5%=10.815,
答:硼的相对平均原子质量为10.815.
点评 本题考查物质的量的计算,题目难度不大.正确理解元素的相对平均原子质量的计算方法是解本题关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
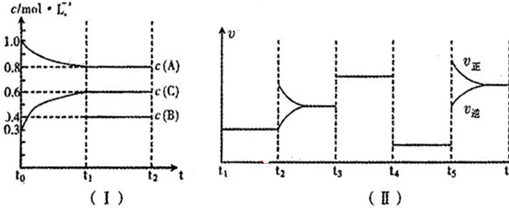
| t1~t2 | t2~t3 | t3~t4 | t4~t5 | t5~t6 |
| K1 | K2 | K3 | K4 | K5 |
 3C(g)△H=+200a kJ/mol
3C(g)△H=+200a kJ/mol查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的液化、石油的裂化和油脂的皂化都属于化学变化 | |
| B. | 糖、油脂和蛋白质都是人体生命活动所需的基本营养物质 | |
| C. | 静电除尘、燃煤固硫和汽车尾气催化净化都有利于改善空气质量 | |
| D. | 硝酸纤维、聚酯纤维和光导纤维都可由纤维素在一定条件下制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2 | B. | SO2 | C. | H2S | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,⑩与⑨形成的5原子分子的结构式为
,⑩与⑨形成的5原子分子的结构式为 .
. ,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.
,氢化物X与化合物Y发生反应的离子方程式为S2-+H2O2=S↓+2OH-.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
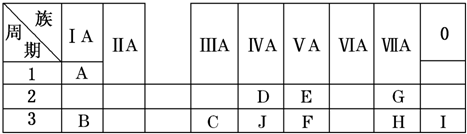
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为新元素的发现及预测它们的原子结构和性质提供线索 | |
| B. | 利用元素周期表发现元素的种类和原子的种类相同 | |
| C. | 在周期表中金属与非金属的分界处,可寻找半导体材料 | |
| D. | 指导人们在过渡元素中寻找催化剂和耐高温.耐腐蚀的合金材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
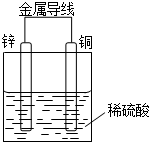 某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告
某同学设计出如下原电池原理和实验装置来证明Cu和Zn的金属活动性顺序.请你完成下列实验报告查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com