
| 物质 | W(g) | X(g) | Y(g) | Z(g) |
| 初始浓度(mol/L) | 4.0 | 2.0 | 0 | 0 |
| 2min末浓度(mol/L) | 2.4 | 1.2 | 0.8 | 1.6 |
| A. | 2min内X的平均速率为0.6mol/(L•min) | |
| B. | 该反应的化学方程式可表示为:2W(g)+X(g)?2Y+Z | |
| C. | 若达到平衡后保持压强不变充入Ne,平衡不移动 | |
| D. | 平衡后再加入W,则W的转化率增大 |
分析 A.根据v=$\frac{△c}{△t}$2min内X的平均速率;
B.根据物质的量的变化,判断出反应物、生成物及是否是可逆反应,利用物质的量之比化学计量数之比书写方程式;
C.根据该反应特点及压强对化学平衡的影响分析;
D.平衡后再加入W,W的转化率会减小.
解答 解:A.2min内X的平均速率为:v(X)=$\frac{(2.0-1.2)mol/L}{2min}$=0.4mol/(L•min),故A错误;
B.2min末各组分的浓度变化为:△n(W)=1.6mol/L、△n(X)=0.8mol/L、△n(Y)=0.8mol/L、△n(Z)=1.6mol/L,浓度变化与化学计量数成正比,则该反应方程式为:2W(g)+X(g)?Y(g)+2Z(g),故B错误;
C.反应2W(g)+X(g)?Y(g)+2Z(g)为气体体积不变的反应,压强不影响平衡,则若达到平衡后保持压强不变充入Ne,平衡不移动,故C正确;
D.平衡后再加入W,平衡向着正向移动,但W的转化率会减小,故D错误;
故选C.
点评 本题考查化学平衡的影响因素,题目难度中等,明确化学反应速率与化学计量数的关系为解答关键,注意熟练掌握化学平衡及其影响,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H218O═4NaOH+18O2↑ | |
| B. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O | |
| C. | NH4Cl+2H2O?NH3•2H2O+HCl | |
| D. | CH3COOH+CH3CH218OH$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 组别 | Ⅰ | Ⅱ |
| A | 常温下,乙烯和氯气混合 | 乙烷和氯气混合光照 |
| B | 乙酸、乙醇、浓硫酸混合,加热 | 在FeBr3催化下,苯与液溴反应 |
| C | 苯和浓硫酸、浓硝酸混合,加热到50~60℃ | 乙烯在一定条件下与水反应 |
| D | 由乙烯制取聚乙烯 | 蔗糖与稀硫酸混合,加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①是铝热反应 | B. | 反应②是置换反应 | C. | C2Cl6属于卤代烃 | D. | 氧化性:Al<Zn<C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 充电时电极b连接电源的正极 | |
| B. | 放电时右侧电解质储罐中的离子总浓度增大 | |
| C. | 放电时电极a连接粗铜可实现粗铜的精炼 | |
| D. | 充电时阴极反应式为2H++2e-=H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属间发生置换反应 | |
| B. | 金属元素的最高价氧化物对应水化物的碱性强弱 | |
| C. | 1mol金属单质在反应中失去电子的多少 | |
| D. | 金属元素的单质与水或酸反应置换出氢气的难易 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
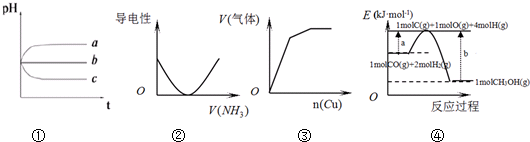
| A. | 图①:pH相同的H2S溶液(a)、稀H2SO4溶液(b)、H2SO3溶液(c)露置于空气中一段时间后,溶液的pH随时间的变化情况 | |
| B. | 图②:表示向乙酸溶液中通入NH3过程中溶液导电性的变化 | |
| C. | 图③:将铜粉加入到一定量浓硝酸中产生的气体与加入铜量的变化情况 | |
| D. | 图④:合成甲醇的热化学方程式为CO(g)+2H2(g)=CH3OH(g)△H=a-b kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
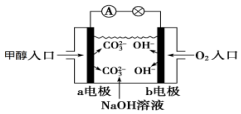 如图是甲醇燃料电池原理示意图,请回答下列问题:
如图是甲醇燃料电池原理示意图,请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com