
分析 (1)纯碱是碳酸钠,属于盐;
(2)碳酸钠和盐酸、硫酸、硝酸反应生成二氧化碳气体;
(3)依据金属活动顺序表分析判断,氢前金属稀硫酸发生反应生成氢气;
(4)当4.4g CO2全部通入95.6烧碱溶液后,恰好完全反应得到某正盐溶液,生成的为碳酸钠溶液,依据化学方程式定量关系计算得到正盐的质量,溶液质量=二氧化碳质量+硫酸溶液质量.
解答 解:(1)硝酸、硫酸和盐酸属于酸,烧碱是氢氧化钠,属于碱,纯碱是碳酸钠,属于盐,
故答案为:Na2CO3;
(2)①盐酸和碳酸钠反应生成氯化钠、二氧化碳和水,反应的化学方程式为:2HCl+Na2CO3=2NaCl+CO2↑+H2O,
故答案为:2HCl+Na2CO3=2NaCl+CO2↑+H2O;
②硫酸和碳酸钠反应生成硫酸钠、二氧化碳和水,反应的化学方程式为:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O,
故答案为:H2SO4+Na2CO3=Na2SO4+CO2↑+H2O;
③硝酸和碳酸钠反应生成硝酸钠、二氧化碳和水,反应的化学方程式为:2HNO3+Na2CO3=2NaNO3+CO2↑+H2O,
故答案为:2HNO3+Na2CO3=2NaNO3+CO2↑+H2O;
(3)金属活动顺序表分析判断,氢前金属稀硫酸发生反应生成氢气,在常温时不能溶于足量稀硫酸的是Au、Cu,Fe、Al和稀硫酸发生反应,故选AB,
故答案为:AB;
(4)CO2+2NaOH=Na2CO3+H2O
44 106
4.4g m(Na2CO3)
求得:m(Na2CO3)=10.6g
Na2CO3溶液中溶质的质量分数=$\frac{10.6g}{4.4g+95.6g}$×100%=10.6%,
故答案为:10.6%.
点评 本题考查了物质分类,概念判断,物质性质的综合应用,主要考查酸碱盐的概念判断,金属和酸反应的规律,化学方程式的计算,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 测定溶液pH时,pH试纸先用蒸馏水润湿 | |
| B. | 蒸馏实验中,蒸馏前必须在蒸馏烧瓶中加入碎瓷片 | |
| C. | 用盐酸滴定滴定氨水实验中,用甲基橙作指示剂以减小实验误差 | |
| D. |  用如图所示的方法排除碱式滴定管胶管中的气泡 用如图所示的方法排除碱式滴定管胶管中的气泡 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Fe2O3、Fe3O4、FeO | B. | FeO、Fe3O4 | C. | Fe3O4、Fe2O3 | D. | FeO、Fe2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该实验需要用的主要玻璃仪器有:两个大小相同的烧杯、两只大小相同的量筒、温度计、环形玻璃搅拌棒 | |
| B. | 能用保温杯代替烧杯做有关测定中和热的实验 | |
| C. | 该实验至少需要测定并记录温度的次数是3次 | |
| D. | 若NaOH的物质的量稍大于HCl,会导致所测中和热数值偏高 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
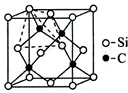 铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:
铜、镓、硒、硅等元素的化合物是生产第三代太阳能电池的重要材料.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com