
对于工业生产硫酸的反应:SO2(g)+1/2O2(g)  SO3(g);ΔH=-98.3
kJ·mol-1
SO3(g);ΔH=-98.3
kJ·mol-1
下列图象表示正确的是
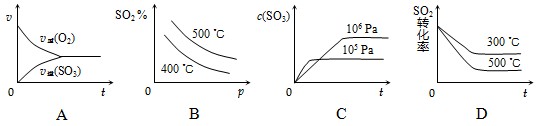
B
【解析】
试题分析:平衡时氧气的反应速率和SO2的反应速率是不相等的,A不正确;正反应是体积减小的、放热的可逆反应,所以B正确;压强大,反应速率快,达到平衡的时间短,C不正确;温度高,反应速率快,达到平衡的时间短,D不正确,答案选B。
考点:考查外界条件对反应速率和平衡状态的影响以及图像识别等。
点评:在分析有关图像时应该注意:
一、ν-t 图像或 c-t 图像:1.ν-t 图像:分清正逆反应,分清各因素(浓度、温度、压强、催化剂)对反应速率和平衡移动的影响。
二、平衡图像 1.出现拐点的图像:分析依据“先拐先平”。在转化率-时间图像或物质的百分含量-时间图像中,先出现拐点的曲线先达到平衡(代表温度高或压强大或使用合适的催化剂等)。


科目:高中化学 来源: 题型:
 以工业废料铁泥(主要成分为Fe2O3)为原料生产七水合硫酸亚铁的工艺流程如下:
以工业废料铁泥(主要成分为Fe2O3)为原料生产七水合硫酸亚铁的工艺流程如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com