
| A.物质的量浓度c(甲)=10c(乙) |
| B.甲中由水电离产生的H+的物质的量浓度是乙的0.1倍? |
| C.中和等物质的量浓度等体积的NaOH溶液需甲、乙两酸的体积V(乙)=10V(甲) |
| D.甲中c(OH-)为乙中c(OH-)的10倍 |
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:阅读理解
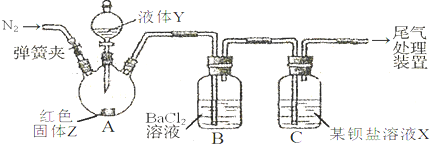
| 操 作 | 现 象 |
| 关闭弹簧夹,滴加一定量液体Y,加强热; | A中有白雾生成,红色固体Z的表面产生气泡.B中有气泡冒出,产生大量白色沉淀.C中产生白色沉淀,液面上方略显红棕色并逐渐消失. |
| 打开弹簧夹,通入气体N2,停止加热,一段时间后关闭; | |
| 从B、C中分别取少量白色沉淀,加稀盐酸. | 均未发现白色沉淀溶解 |
| ||
| ||
| 甲 | 大量不溶于稀盐酸的白色沉定 |
| 乙 | 少量不溶于稀盐酸的白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:上海市奉贤区2012届高三4月调研考试(二模)化学试题 题型:058
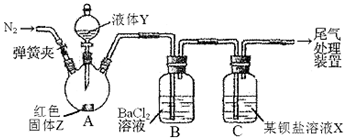
为探究SO2与可溶性钡盐能否反应生成白色BaSO3沉淀,甲、乙两同学用下图所示装置进行实验(夹持装置、加热装置已略,气密性已检验)
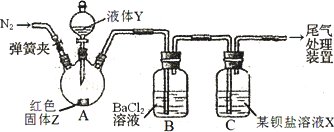
实验操作和现象:
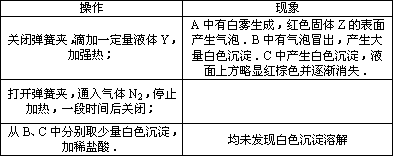
1.A中反应的化学方程式是________.
2.C中可溶性钡盐溶液X为________.实验过程中,发现液体Y不能很顺利地滴下,则可如何改进:________.
3.分析B中不溶于稀盐酸的沉淀的产生原因,甲同学认为是________,乙同学认为是白雾参与反应.
为证实各自的观点,在原实验基础上;甲同学在原有操作之前,先通N2一段时间.乙同学则在A、B间增加盛有饱和NaHSO3溶液的洗气瓶D.
甲、乙各自进行实验,B中现象分别如下表:由此得出的结论是________.
![]()
4.丙将甲乙两同学的方案进行联合试验,发现B中无沉淀生成,而C中产生白色沉淀,但无红棕色气体.C中反应的化学方程式是________.
5.丁同学认为丙选择的两种钡盐比较相似,于是丁在丙的基础上将B、C中的钡盐分别换成过量新制的醋酸钡溶液、Ba(AlO2)2溶液,发现B、C中均立即产生大量白色沉淀,该沉淀可溶于稀盐酸,并产生能使澄清石灰水浑浊的气体.C中沉淀为________.实验室里欲获得该沉淀,所需要的玻璃仪器是________.
6.结合实验目的,根据四位同学的实验操作和实验现象,你得出的结论是________.
查看答案和解析>>
科目:高中化学 来源:2010-2011年福建安溪一中、惠安一中、养正中学高二上学期期末联考化学卷 题型:实验题
(13分)
(1)某化学实验小组从市场上买来一瓶食用白醋(含CH3COOH),用实验室标准NaOH溶液对其进行滴定以测定醋酸浓度,完全反应时所得溶液pH大致为9 。下表是4种常见指示剂的变色范围:
|
指示剂 |
石蕊 |
甲基橙 |
甲基红 |
酚酞 |
|
变色范围(pH) |
5.0~8.0 |
3.1~4.4 |
4.4~6.2 |
8.2~10.0 |
①该实验应选用 作指示剂。
②下图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL;

③为减小实验误差,该同学一共进行了三次实验,假设每
次所取白醋体积均为VmL,NaOH标准液浓度为c mo1/L,三次实验
结果记录如下:

从上表可以看出,第一次实验中记录消耗NaOH溶液的体积明显多于后两次,其原因可能是 。
A.实验结束时,俯视刻度线读取滴定终点时NaOH溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束尖嘴部分充满溶液
C.盛装白醋溶液的滴定管用蒸馏水洗过,未用白醋溶液润洗
D.滴加NaOH溶液时,未充分振荡,刚看到溶液变色,立刻停止滴定
(2)乙二酸俗名草酸,某化学学习小组的同学欲探究测定草酸晶体(H2C2O4·xH2O)中x值。查阅资料得知,草酸易溶于水,有还原性,可以用酸性KMnO4溶液进行滴定:
2MnO4-+5H2C2O4+6H+ 2Mn2++10CO2↑+8H2O
该组同学设计了滴定的方法测定x值。
称取1.260 g纯草酸晶体,配制成100.00 mL水溶液为待测液;
取25.00 mL待测液放入锥形瓶中,再加入适量的稀H2SO4;
用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,达到终点时消耗10.00 mL;
请回答:
①滴定时,将KMnO4标准液装在下图中的 (填“甲”或“乙”)滴定管中。\

② 本实验滴定达到终点的标志是
③通过上述数据,计算出x=
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
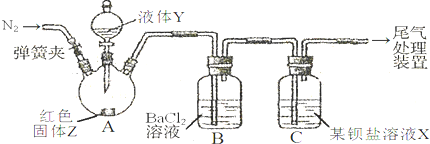
| 操 作 | 现 象 |
| 关闭弹簧夹,滴加一定量液体Y,加强热; | A中有白雾生成,红色固体Z的表面产生气泡.B中有气泡冒出,产生大量白色沉淀.C中产生白色沉淀,液面上方略显红棕色并逐渐消失. |
| 打开弹簧夹,通入气体N2,停止加热,一段时间后关闭; | |
| 从B、C中分别取少量白色沉淀,加稀盐酸. | 均未发现白色沉淀溶解 |
| 甲 | 大量不溶于稀盐酸的白色沉定 |
| 乙 | 少量不溶于稀盐酸的白色沉淀 |
查看答案和解析>>
科目:高中化学 来源:上海模拟题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com