
科目:高中化学 来源: 题型:解答题
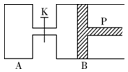 图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:
图中,P为一可自由滑动的活塞,关闭K,分别向容器A、B中各充入1mol X、1mol Y,起始时,VA=a L,VB=0.8a L(连通管的体积忽略不计),在相同温度和有催化剂存在的条件下,两容器中各自发生下述反应:3X(g)+3Y(g)?2Z(g)+2W(g),达平衡时,VB=0.6a L.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
在水中加入下列物质 ,可使水的电离平衡正向移动的是( )
,可使水的电离平衡正向移动的是( )
A.NaOH B.NH4Cl C.NaCl D.H2SO4
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上10月月考化学试卷(解析版) 题型:选择题
氨水中所含的分子和离子有 
①NH4+ ②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A.①②③ B.②③④⑤ C.②③④⑤⑥ D.①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2017届安徽省黄山市高三上月考二化学卷(解析版) 题型:实验题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I.制取NaClO2晶体
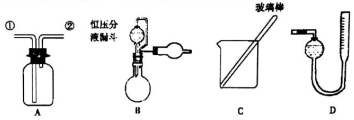
已知:NaClO2饱和溶液在温度低于38 ℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60 ℃时NaClO2分解成NaClO3和NaCl。现利用下图所示装置进行实验。

(1) 装置③的作用是 。
(2) 装置②中产生ClO2的化学方程式为 ;装置④中制备NaClO2的化学方程式为 。
(3) 从装置④反应后的溶液获得NaClO2晶体的操作步骤如下:
① 减压,55 ℃蒸发结晶;② 趁热过滤;③ ;④ 低于60 ℃干燥,得到成品。
实验II.测定某亚氯酸钠样品的纯度
设计如下实验方案,并进行实验:
① 确称取所得亚氯酸钠样品m g于烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2- + 4 I- + 4 H+ = 2 H2O + 2 I2 + Cl-);将所得混合液配成250 mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用cmol·L-1Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为VmL(已知:I2+2S2O32-=2I-+S4O62-)。
(4) 达到滴定终点时的现象为 。
(5) 该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6) 在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源:2017届重庆一中高三上学期第二次月考化学试卷(解析版) 题型:实验题
2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
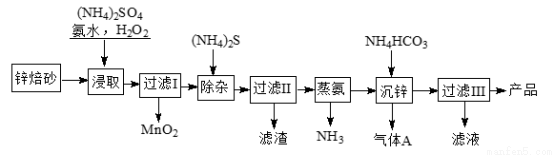
请回答下列问题:
(1)当(NH4)2SO4、NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42?)时,溶液呈 (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是 (任写两种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为 。
(4)适量S2?能将Cu2+硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?用计算说明原因: 。
[已知:Ksp(ZnS)=1.6×10?24,Ksp(CuS)=1.3×10?36;一般认为反应的平衡常数K>105,该反应进行基本完全。]
(5)“沉锌”的离子方程式为___________________。
(6)上述流程中多次需要过滤,实验室进行过滤操作需要用到的玻璃仪器有__________。“过滤III”所得滤液可循环使用,产品需洗涤干燥后备用,检验产品洗涤干净的操作和现象是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
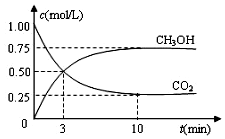 目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.
目前工业上可用CO2来生产燃料甲醇,有关反应为:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.现向体积为1L的密闭容器中,充入1mol CO2和3mol H2,反应过程中测得CO2和CH3OH(g)的浓度随时间的变化如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com