
镁铝合金5.1 g完全溶于过量的热浓硝酸中,反应中共产生11.2 L NO2(标准状况下测定),若在反应后溶液中加入足量的氢氧化钠溶液,则生成沉淀的质量为( )
A.13.6 g B.7.8 g C.5.8 g D.4 g
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014高考化学苏教版总复习 专题7化学反应速率与化学平衡练习卷(解析版) 题型:选择题
下图表示反应X(g)+4Y(g)  5Z(g) ΔH<0,在某温度时X的浓度随时间变化的曲线:
5Z(g) ΔH<0,在某温度时X的浓度随时间变化的曲线:
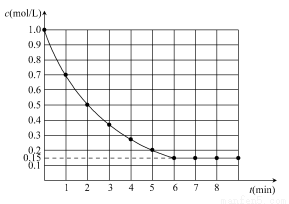
下列有关该反应的描述正确的是( )
A.若Z是有色气体,只压缩容器的体积,平衡不移动,则气体颜色不变
B.若升高温度,则X的平衡转化率减小,v(逆)增大,v(正)减小
C.若X和Y的平衡转化率相等,则起始时X和Y的物质的量之比为1:4
D.若平衡时X的转化率为85%,则起始时Y的物质的量浓度为3.4 mol/L
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题5微观结构与物质的多样性练习卷(解析版) 题型:填空题
A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别同主族,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。请回答下列问题:
(1)A元素单质的化学式为________,D元素的原子结构示意图为_______。
(2)由A、B、C三种元素形成的化合物的电子式为________,这种化合物形成的晶体中所含的化学键类型有________。
(3)A、B、D三种元素形成的一种化合物和A、B形成的一种化合物能发生氧化还原反应,反应的化学方程式为__________________。
(4)B、C、E三种元素形成一种盐,此盐中三种原子的个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:填空题
印刷电路的废腐蚀液中含有大量CuCl2、FeCl2和FeCl3,任意排放将导致环境污染及资源的浪费,可从该废液中回收铜,并将铁的化合物全部转化为FeCl3溶液,作为腐蚀液原料循环使用。
(1)测得某废腐蚀液中含CuCl2 1.5 mol·L-1、FeCl2 3.0 mol·L-1、FeCl3 1.0 mol·L-1、HCl 3.0 mol·L-1。
取废腐蚀液200 mL按如下流程在实验室进行实验:
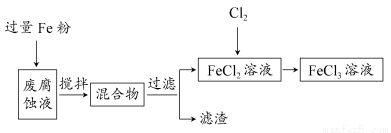
回答下列问题:
①废腐蚀液中加入过量铁粉后,发生反应的离子方程式为________。
②检验废腐蚀液中含有Fe3+的实验操作是________;在上述流程中,“过滤”用到的玻璃仪器有烧杯、玻璃棒、________。
③由滤渣得到纯铜,除杂所需试剂是________。
(2)某化学兴趣小组利用下图所示装置制取氯气并通入到FeCl2溶液中获得FeCl3溶液。
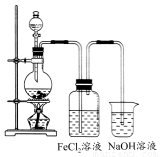
①实验开始前,某同学对实验装置进行了气密性检查,方法是________。
②浓盐酸与二氧化锰加热反应的化学方程式为________;烧杯中NaOH溶液的作用是________。
③参考(1)中数据,按上述流程操作,需称取Fe粉的质量应不少于________g,需通入Cl2的物质的量应不少于________ mol。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:选择题
下列有关铁元素的叙述中正确的是( )
A.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性:
Fe(OH)2<Fe(OH)3
B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3
C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O
D.铁元素位于周期表的第四周期第ⅧB族
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题3从矿物到基础材料练习卷(解析版) 题型:选择题
硅作为一种新型能源被广泛开发利用,关于其有利因素下列说法中,你认为不正确的是( )
A.硅燃烧产物对环境产生的污染,容易得到有效控制
B.从Si(s)+O2(g)  SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
SiO2(s) ΔH=-858.6 kJ·mol-1可知,硅燃烧放出的热量多
C.自然界中硅的贮存量丰富,可以从自然界直接获得单质硅
D.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料之一
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:填空题
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO42-等杂质,提纯工艺路线如下:
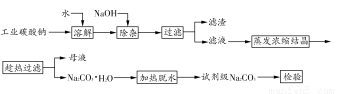
已知碳酸钠的溶解度(S)随温度变化的曲线如下图所示:
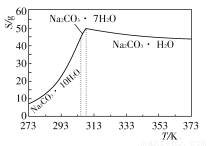
回答下列问题:
(1)滤渣的主要成分为____________________________________。
(2)“趁热过滤”的原因是_______________________________________。
(3)若在实验室进行“趁热过滤”,可采用的措施是__________(写出1种)。
(4)若“母液”循环使用,可能出现的问题及其原因是_______________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g)ΔH1=+532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g)ΔH2=+473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式______________________。
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题2从海水中获得的化学物质练习卷(解析版) 题型:选择题
下列用品的有效成分及用途对应错误的是( )
ABCD
用品



有效成分NaClNa2CO3Al(OH)3Ca(ClO)2
用途做调味品做发酵粉做抗酸药做消毒剂
查看答案和解析>>
科目:高中化学 来源:2014高考化学苏教版总复习 专题13化学与技术练习卷(解析版) 题型:选择题
以油类为溶剂的防锈漆称为油基防锈漆,由于环保方面的原因,目前要推广使用水基防锈漆,但水基漆较易溶解O2,在干燥之前易导致金属表面产生锈斑,为此要在水基漆中加入缓蚀剂以除去氧气,以下可作为缓蚀剂的是( )
A.KMnO4 B.NaNO2 C.FeCl3 D.HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com