
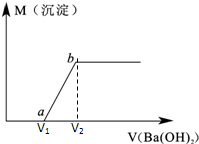
 某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.
某溶液由盐酸、Na2CO3、H2SO4、CuCl2四种物质中的一种或几种混合形成,现向该混合溶液中滴加Ba(OH)2溶液,产生沉淀的质量与加入Ba(OH)2溶液体积的关系如图所示.| 2.94g |
| 98g/mol |
| 0.03mol |
| 0.02L |


科目:高中化学 来源: 题型:
 现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题:
现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加人KBrO3的物质的量的关系如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,48gO3含有的氧原子数为NA个 |
| B、24g金属镁变为镁离子时失去的电子数为NA个 |
| C、在0℃、101kP时,28gN2和CO的混合气体,其体积约为22.4L |
| D、同温同压下,NA个NO与NA个N2和O2的混合气体的体积不相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO转化为CO2的热化学方程式为2CO(g)+O2(g)═2CO2(g)△H=-566 kJ?mol-1 | ||
B、CO燃烧热的热化学方程式为CO(g)+
| ||
| C、放热反应可能需要加热才能进行,而吸热反应一定需要加热才能进行 | ||
| D、1mol H2完全燃烧生成1mol 液态水,放出的热量大于242 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸和氢氧化钠溶液反应 |
| B、氢氧化镁和盐酸反应 |
| C、澄清石灰水和硝酸反应 |
| D、氢氧化钡和稀硫酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com