
【题目】下列物质属于纯净物的是( )
A. 普通玻璃 B. 空气 C. 漂白粉 D. 干冰
 天天向上一本好卷系列答案
天天向上一本好卷系列答案科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中充入一定量A和B,发生如下反应:xA(g)+2B(s) ![]() yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:
yC(g) ΔH<0,一定条件下,容器中A、C的物质的量浓度随时间变化的曲线如图所示。请回答下列问题:

(1)用A的浓度变化表示该反应在0~10 min内的平均反应速率v(A)=______________________。
(2)根据图示可确定x∶y=________。
(3)0~10 min容器内压强________(填“变大”、“不变”或“变小”)。
(4)推测第10 min引起曲线变化的反应条件可能是______________________;第16min引起曲线变化的反应条件可能是________________________。
①减压 ②增大A的浓度 ③增大C的量 ④升温⑤降温 ⑥加催化剂
(5)若平衡Ⅰ的平衡常数为K1,平衡Ⅱ平衡常数为K2,则K1________K2(填“>”、“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图甲装置进行实验,若图乙中横坐标X表示通过电极的电子的物质的量。下列叙述不正确的是( )
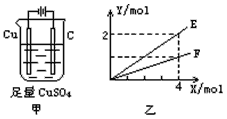
A. E表示反应消耗H2O的物质的量
B. E表示反应生成H2SO4的物质的量
C. F表示反应生成Cu的物质的量
D. F表示反应生成O2的物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0 L的恒容密闭容器中反应2H2(g)+CO(g)![]() CH3OH(g) 达到平衡。下列说法正确的是( )
CH3OH(g) 达到平衡。下列说法正确的是( )
容器 | 温度/K | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
Ⅰ | 400 | 0.20 | 0.10 | 0 | 0.080 |
Ⅱ | 400 | 0.40 | 0.20 | 0 | |
Ⅲ | 500 | 0 | 0 | 0.10 | 0.025 |
A. 该反应的正反应吸热
B. 达到平衡时,容器Ⅱ中c(CH3OH)小于容器Ⅰ中c(CH3OH) 的两倍
C. 达到平衡时,容器Ⅱ中c(H2)大于容器Ⅲ中c(H2)的两倍
D. 达到平衡时,容器Ⅲ中的正反应速率比容器Ⅰ中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作(或注意事项)中,主要是出于实验安全考虑的是
A. 实验剩余的药品不能放回原试剂瓶 B. 可燃性气体的验纯
C. 气体实验装置在实验前进行气密性检查 D. 滴管不能交叉使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,其中Z为金属且Z的原子序数为W的2倍。n、p、q是由这些元素组成的二元化合物,常温下,n为气体。m、r、s分别是Z、W、X的单质,t的水溶液呈碱性焰色反应呈黄色,上述物质间的转化关系如图所示。下列说法正确的是

A. 简单离子半径:Z>Y>X B. 化合物P中只存在离子键
C. 图示转化关系涉及的反应均为氧化还原反应 D. 最简单气态氢化物的稳定性:W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性。
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:

①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为:
___________________________________________________________________________
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)= _________________________。
③往1L1.00 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol。
④已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是____________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50 mol·L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
①在25℃下,将a molL—1的NH4Cl溶液与0.01molL—1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=___________mol L—1。
②若25℃时将浓度均为0.1molL—1的NH4Cl、NH3·H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____________(填字母)。
a.此溶液一定有c(NH4+)+ c ( H+) = c(OH—) +c ( Cl—)
b.此溶液一定有c(Cl-) = c (NH3·H2O) +c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1 mol/L的H2C2O4溶液中H2C2O4、HC2O4-、C2O42-三者中所占物质的量分数(分布系数)随pH变化的关系如图所示。下列表述不正确的是
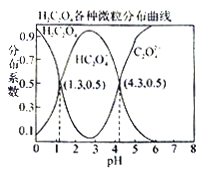
A. HC2O4-![]() H++C2O42-,K=1×10-4.3
H++C2O42-,K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. 常温下HF的K=1×10-3.45,将少量H2C2O4溶液加入到足量NaF溶液中,发生的反应为:H2C2O4+F-=HF+HC2O4-
D. 在0.1 mol/LNaHC2O4溶液中,各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com