
【题目】将1.20 g铁铜合金完全溶于100 mL、12.0 mol·L1浓硝酸中,得到NO2和N2O4混合气体672 mL(换算为标准状况下)。向反应后的溶液中加入1.0 mol·L1 NaOH溶液,当金属离子全部沉淀时,得到2.05 g沉淀。下列有关判断正确的是
A.反应过程中浓硝酸仅体现氧化性
B.该合金中铁与铜物质的量之比是2∶1
C.混合气体中,NO2的体积分数是![]()
D.金属离子全部沉淀时,加入NaOH溶液的体积至少为1100 mL
【答案】C
【解析】A.金属与浓硝酸反应过程中体现浓硝酸的氧化性和酸性,故A错误;B.金属离子全部沉淀时,得到2.05 g沉淀为氢氧化铜、氢氧化铁,故沉淀中氢氧根离子的质量为:2.05 g1.20 g=0.85 g,氢氧根离子的物质的量为:![]() =0.05 mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根离子的物质的量,设铜、铁合金中Cu、Fe的物质的量分别为x mol、y mol,则:2x+3y=0.05、64x+56y=1.20,解得:x=0.01、y=0.01,则该合金中n(Cu)∶n(Fe)=1∶1,故B错误;C.标况下0.672 L气体的物质的量为:
=0.05 mol,根据电荷守恒可知,金属提供的电子物质的量等于氢氧根离子的物质的量,设铜、铁合金中Cu、Fe的物质的量分别为x mol、y mol,则:2x+3y=0.05、64x+56y=1.20,解得:x=0.01、y=0.01,则该合金中n(Cu)∶n(Fe)=1∶1,故B错误;C.标况下0.672 L气体的物质的量为:![]() =0.03 mol,设混合气体中二氧化氮的物质的量为a mol,则四氧化二氮的物质的量为(0.03a) mol,根据电子转移守恒可知:a×1+(0.03a)×2×1=0.05,解得a=0.01,则混合气体中含有二氧化氮0.01 mol、四氧化二氮0.02 mol,NO2和N2O4的混合气体中,NO2的体积分数为
=0.03 mol,设混合气体中二氧化氮的物质的量为a mol,则四氧化二氮的物质的量为(0.03a) mol,根据电子转移守恒可知:a×1+(0.03a)×2×1=0.05,解得a=0.01,则混合气体中含有二氧化氮0.01 mol、四氧化二氮0.02 mol,NO2和N2O4的混合气体中,NO2的体积分数为![]() ,故C正确;D.100 mL、12.0 mol·L1浓硝酸中含有硝酸的物质的量为:12 mol/L×0.1 L=1.2 mol,反应后的溶质为硝酸钠,根据N元素守恒,硝酸钠的物质的量为:1.2 mol0.010.02×2=1.15 mol,故需要氢氧化钠溶液的体积为:
,故C正确;D.100 mL、12.0 mol·L1浓硝酸中含有硝酸的物质的量为:12 mol/L×0.1 L=1.2 mol,反应后的溶质为硝酸钠,根据N元素守恒,硝酸钠的物质的量为:1.2 mol0.010.02×2=1.15 mol,故需要氢氧化钠溶液的体积为:![]() =1.15 L=1150 mL,故D错误;故选C。
=1.15 L=1150 mL,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】在含少量Mg粉的试管中滴入稀盐酸,产生大量气泡,且试管壁发热。该反应为( )
A. 放热反应 B. 吸热反应 C. 化合反应 D. 复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行反应:C(s) + H2O(g)= CO(g) + H2(g),下列条件的改变对反应速率几乎无影响的是( )
A.增加CO的量B.保持体积不变,充入N2,使体系的压强增大
C.将容器的体积缩小一半D.保持压强不变,充入N2,使容器的体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用 0.10 mol·L-1的氨水滴定10.0mL a mol L-1的盐酸,溶液的pH与氨水体积(V)的关系如图所示。已知:N点溶液中存在:c(Cl-)=c(NH4+)+c(NH3·H2O)。下列说法不正确的是
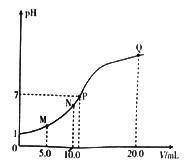
A. a=0.10
B. N、P两点溶液中水的电离程度:N
C. M、N两点溶液中NH4+的物质的量之比大于1:2
D. Q 点溶液中存在:2c(OH-)-2c(H+)=c(NH4+)-c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Na、Na2O、Na2O2的混合物与足量水反应,在标准状况下得到6.72L 混合气体,将混合气体用电火花引燃,恰好完全反应,则Na与Na2O2的物质的量之比为
A. l : 2 B. 1 : 1 C. 2 : 1 D. 3 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将13.6 g带铁锈的铁片溶解于25 mL、14 mol/L的热的浓硫酸中,气体只有SO2且体积为1.12 L(标准状况)。将溶液稀释至100 mL,所得溶液遇KSCN溶液时无血红色出现。下列结论正确的是
A.反应中:转移电子3.01×1022个 B.反应后:剩余硫酸0.30 mol
C.原混合物:n(Fe2O3)∶n(Fe)=1∶2 D.所得溶液:c(FeSO4)=1.7 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①向KMnO4晶体滴加浓盐酸,产生黄绿色气体;②向FeCl2溶液中通入少量实验①产生的气体,溶液变黄色;③取实验②生成的溶液滴在淀粉KI试纸上,试纸变蓝色。下列判断不正确的是
A.上述实验证明氧化性:MnO4->Cl2>Fe3+>I2
B.实验①中,用160 mL 10 mol/L的高锰酸钾溶液与足量KMnO4充分反应,标准状况下可制得11.2 L的Cl2
C.实验①生成的气体能使湿润的淀粉KI试纸变蓝
D.实验①中要收集纯净干燥的黄绿色气体,应将气体依次通过饱和食盐水和浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法不正确的是
A. 常温常压下,35.5g的氯气与足量的氢氧化钙溶液完全反应,转移的电子数为0.5NA
B. 60g甲酸甲酯和葡萄糖的混合物含有的碳原子数目为2NA
C. 标准状况下,2.24L PH3与3.4gH2S气体分子所含电子数目均为1.8NA
D. 已知合成氨反应N2(g)+3H2(g)![]() 2NH3(g) △H= -92.4kJ/mol当该反应生成NA个NH3分子时,反应放出的热量小于46.2kJ
2NH3(g) △H= -92.4kJ/mol当该反应生成NA个NH3分子时,反应放出的热量小于46.2kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究在加热条件下FeSO4分解的气体产物及相关性质。已知:SO2的沸点为-10℃、SO3的沸点为44.8℃。
Ⅰ.用如图所示装置设计实验,验证分解FeSO4生成的气态产物。

(1)实验前必须进行的操作是_______________________。
(2)按气流方向连接各仪器,用字母表示接口的连接顺序:a→_________________。
(3)若观察到装置丙中有无色液体产生,装置丁中溶液变成无色,则 FeSO4分解的化学方程式为____________________。
Ⅱ.为探究SO2使品红溶液褪色的原理,进行如下实验:
实验1:将稀盐酸和NaOH溶液分别滴入品红水溶液中。观察到前者溶液颜色变浅,但未能完全褪色,后者溶液颜色几乎不变。
实验2:在滴有稀盐酸和NaOH溶液的两份品红水溶液中分别通入SO2。观察到前者溶液逐渐褪色,后者溶液很快褪色。
实验3:在两份品红水溶液中分别加入一小粒Na2SO3固体和NaHSO3固体,前者溶液很快褪色,后者溶液褪色很慢。
(1)由实验1可推测品红水溶液呈________性。
(2)由实验2、3可推知,使品红水溶液褪色的主要微粒是_________(填化学式)。
(3)若将SO2通入品红的无水乙醇溶液,试预测可能出现的现象________________。
(4)加热溶有Na2SO3的品红水溶液,发现不能恢复红色,试解释原因____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com